Опыт 4.1.8. Действие ацетата натрия
Соли алюминия взаимодействуют с ацетатом натрия CH3COONa с образованием растворимого ацетата алюминия, который при нагревании гидролизуется, в результате чего выпадает аморфный осадок основной соли алюминия:
Al3+ + 2CH3COO– + H2O → AlOH(CH3COO)2 + H+
Выполнение опыта:
В пробирку поместить 1 мл соли алюминия, прилить столько же ацетата натрия. Содержимое пробирки осторожно нагреть до кипения. Наблюдать образование осадка. Записать наблюдения и уравнения реакции в тетрадь.
Опыт 4.1.9. Реакция с оксихинолином
В присутствии ацетатного буферного раствора рН= 4,5 – 10 оксихинолин С9Н6N(ОН) с ионами алюминия образует желто-зеленый кристаллический осадок внутрикомплексного соединения [Al(Ox)3] или (С9Н6NО)3Al:
Al3+ + 3С9Н6N(ОН) → Al(С9Н6NО)3¯+ 3H+
Осадок обладает флуоресцирующим свойством, в ультрафиолетовом цвете светиться. Реакцию иногда выполняют капельным способом на фильтровальной бумаге.
Реакция весьма чувствительна, но мало селективна. Мешают открытию ионы: Са2+, Mg2+, Sr2+, Ba2+, Zn2+, Cd2+, Sn2+.
Выполнение опыта:
В пробирку внести 2 – 5 капель раствора соли алюминия, добавить ацетатный буферный раствор до рН = 6,5 – 9, затем 5 – 6 капель 1% раствора оксихинолина. Наблюдать образование зеленовато-желтого осадка.
Записать уравнения реакции.
Опыт 10. Реакция с морином
Морин (3,5,7,2,4-пентагидроксифлавон) образует о ионами алюминия при рН = 4–6 (ацетатный буферный раствор) люминесцирующее желто-зеленым цветом комплексное соединение.
Проведению реакции мешают ионы цинка, которые также образуют люминесцирующие комплексы, а также ионы никеля, кобальта, меди, хрома, железа во всех степенях окисления, которые обычно тушат люминесценцию комплекса алюминия с морином.
Выполнение опыта 10:
Опыт 11. Действие сульфида натрия или аммония
Из водного раствора сульфид аммония или натрия (Na2S, (NH4)2S)осаждает катионы Al3+ в виде гидроксида за счет происходящей реакции гидролиза:
2Al3+ + 3S2– + 6H2O → Al(OH)3 + 3H2S
Выполнение опыта:
Поместить в пробирку 2-3 капли раствора соли алюминия, добавить 1-2 капли свежеприготовленного раствора сульфида аммония (NH4)2S. Выпадает осадок сульфида алюминия. Проверить растворимость осадка в соляной и уксусной кислотах.
Записать наблюдения и уравнения реакций.
Опыт 12. Действие растворимых карбонатов
Карбонаты щелочных металлов и аммония (Na2CO3, (NH4)2CO3)взаимодействуют с солями алюминия с образованием осадка гидроксида алюминия вследствие взаимного усиления гидролиза:
2Al3+ + 3CO32– + 3H2O →Al(OH)3 + 3CO2
Выполнение опыта 12:
3. Люминесцентная реакция с 2,3-оксинафтойной кислотой. На фильтровальную бумагу, пропитанную 2,3-оксинафтойной кислотой и гексаметилентетрамином (уротропин), наносят каплю раствора соли аммония и помещают под ультрафиолетовое излучение (λ = 254 нм). При этом 27 наблюдается голубое свечение пятна на зеленом фоне, которое связано с люминесценцией хелатного комплекса алюминия с 2,3-оксинафтойной кислотой: OH COOH 3 + Al3+ OH COO Al 3 0 + 3H+ Аналогичное свечение дает борная кислота и ее соли. Мешающее действие оказывают ионы Fe3+ и Cr3+, гасящие люминесценцию. В их присутствии целесообразно промывать пятно, поместив 1-2 капли воды в его центр. Вследствие радиального перемещения ионов алюминия к периферии образуется голубое светящееся кольцо по краю пятна.
4.2. Реакции катиона цинка Zn2+
Опыт 4.2.1. Действие щелочей (группового реагента)
Катионы цинка при реакциях с щелочами в растворах дают белый осадок гидроксида цинка Zn(OH)2, который растворяется в избытке щелочи с образованием гидроксокомплекса [Zn(OH)4] 2-:
Zn2++ 2OН- → Zn(OH)2↓
Zn(OH)2↓+ 2OН- → [Zn(OH)4] 2-
Гидроксид цинка также растворим в избытке соляной кислоты:
Zn(OH)2 + 2HCl→ ZnCl2 + 2H2O
Выполнение опыта:
К 5-6 каплям раствора соли цинка прилить 1-2 капли щелочи. Наблюдать образование осадка. Полученный осадок разделить на две пробирки. В одну пробирку добавить соляную кислоту, в другую - избыток щелочи.
Что наблюдается? На какие свойства гидроксида цика указывает это явления?
Написать уравнения реакций получения осадка и растворения его в избытке щелочи и кислоты. Назвать комплексное соединение.
Опыт 4.2.2. Реакция с раствором аммиака
Как и щелочи, аммиак вначале образует с катионами Zn2+ белый осадок гидроксида цинка, который при дальнейшем прибавлении раствора аммиака растворяется с образованием бесцветного аммиачного комплекса цинка [Zn(NH3)4]2+:
Zn2+ + 2NH3 + 2H2O ® Zn(OH)2 ¯ + 2NH4+
Zn(OH)2 ¯ + 4NH3 → [Zn(NH3)4]2+ + 2OH-
Ионы цинка в избытке аммиака растворяются с образованием комплексных ионов [Zn(NH3)4]2+ и [Zn(NH3)6]2+. Положение равновесия между этими двумя комплексными ионами зависит от концентрации аммиака в растворе.
Выполнение опыта:
К 3-5 каплям раствора соли цинка прилить 1-2 капли раствора аммиака. Наблюдать образование осадка. К полученному осадку прилить избыток раствора гидроксида аммония до растворения осадка.
Что наблюдается? На какие свойства гидроксида цика указывает это явления?
Написать уравнения реакций получения и растворения осадка. Назвать комрлексное соединение.
Опыт 4.2.3. Действие гексацианоферрата (II) калия K4[Fe(CN)6]
В слабокислой или нейтральной среде ионы цинка (быстрее - при нагревании) образуют с K4[Fe(CN)6] – желтой кровяной солью белый осадок двойной соли:
3ZnCl2 + 2K4[Fe(CN)6] = K2Zn[Fe(CN)6]2↓ + 6KCl
3ZnCl2 + 2K4[Fe(CN)6] = K2Zn[Fe(CN)6]2↓+ 6KCl
3Zn2+ + 2K+ + 2[Fe(CN)6]4- = K2Zn3[Fe(CN)6]2↓
Осадок нерастворим в разбавленной соляной кислоте и растворяется в щелочах, поэтому реакцию нельзя проводить в щелочной среде. Мешают все катионы, образующие малорастворимые ферроцианиды Fe2+, Fe3+, Mn2+ и др. Реакция может быть использована для нахождения цинка в присутствии алюминия, который с этим реагентом не образует осадка. Катионы Cr3+ также не мешают. Предельная концентрация при обнаружении катионов цинка составляет ~1 мкг/мл = 10-6 г/мл.
Реакция фармакопейная.
Выполнение опыта:
К небольшому количеству 1-2 мл раствора соли цинка прилить столько же раствора гексацоаноферрата (II) калия. Наблюдать образование желтовато-белого осадка.
Изучить отношение осадка к щелочи и кислоте.
Записать наблюдения и уравнения реакций. Назвать комплексное соединение.
Опыт 4.2.4. Реакция с дитизоном
Ионы Zn2+ с дитизоном C6H5-NH-N=С(SН)-N=N-C6H5 (дифенилтиокарбазоном) образуют внутрикомплексную соль красного цвета, растворимую в хлороформе (CHCl3).
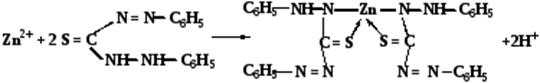
Реакция выполняется в аммиачном буферном растворе и разрешает открывать катионы цинка в присутствии других катионов четвёртой аналитической группы. Реакция высокочувствительна: предел обнаружения - 0,025 мкг. Позволяет открывать катионы цинка при очень низких концентрациях. Мешают катионы, также образующие дитизонатные комплексы (Cd2+, Pb2+, Sn(II) и др.).
Выполнение опыта:
Поместить в пробирку 2-3 капли раствора соли цинка, добавить 2-3 капли ацетатного буфера и затем 2-3 капли 10% раствора дитизона в хлороформе. Энергично встряхнуть пробирку. Образующаяся в результате реакции внутрикомплексная соль экстрагируется в слой хлороформа, и он окрашивается в красный цвет.
Можно провести реакцию обнаружения другим способом. В пробирку внести 5-10 капель раствора ZnCl2, прибавить постепенно несколько капель раствора NaOH до растворения выпавшего белого осадка гидроксида цинка и примерно 5 капель хлороформного раствора дитизона. Пробирку встряхнуть несколько раз. После расслоения смеси хлороформный слой окрашивается в красный цвет.
Записать наблюдения и уравнения реакции в тетрадь.
Опыт 4.2.5. Реакция с сульфидом натрия
Сульфид натрия осаждает из водных растворов солей цинка белый осадок ZnS, который не растворяется в уксусной кислоте и растворяется в разбавленной соляной кислоте:
Zn2+ + S2‾ = ZnS↓
ZnS↓ + 2HCl = ZnCl2 + H2S↑
ZnS↓ + 2Cl‾ = Zn2+ + H2S↑
Катионы Zn2+ образуют с сульфид-ионами S2-в нейтральной, слабокислой или слабощелочной среде (2 < рН < 9).
Реакцию с сульфидами используют как дробную, предварительно выделив мешающие ионы Рb2+ осаждением в виде сульфата, ионы Sn2+ – окисляют Н2О2 до Sn4+, другие мешающие катионы осаждают избытком NaOH. Реакцию часто проводят в уксуснокислой среде, так как в этих условиях открытию Zn2+ не мешают остальные катионы четвертой аналитической группы, за исключением олова.
Реакция фармакопейная.
Выполнение опыта:
Поместить в пробирку 2-3 капли раствора соли цинка, добавить 1-2 капли свежеприготовленного раствора сульфида аммония (NH4)2S. Выпадает белый осадок сульфида цинка. Проверить растворимость осадка в соляной и уксусной кислотах.
Записать наблюдения и уравнения реакций.
Опыт 4.2.6. Реакция с нитратом кобальта
После сжигания кусочка фильтровальной бумаги, смоченной раствором соли цинка и раствором нитрата кобальта образуется пепел, окрашенный в зелёный цвет цинкатом кобальта (смешанного оксида кобальта и цинка CoZnO2) - так называемой «зелени Ринмана»:
Zn(NO3)2 + Co(NO3)2 = CoZnO2 + 4NO2↑ + O2
Выполнение опыта:
В пробирке или в фарфоровом тигле смешать 5 капель раствора Zn(NO3)2 и 5 капель раствора Co(NO3)2. Смесь нагреть до кипения и кипятить около минуты. Горячим раствором смочить полоску фильтровальной бумаги, высушить ее и озолить в фарфоровом тигле на электрической плитке. Образуется зола зеленого цвета.
Записать наблюдения и уравнения реакций.
Опыт 4.2.7. Микрокристаллоскопическая реакция с тетрароданомеркуриатом аммония
Тетрароданомеркуриат (II) аммония (NH4)2[Hg(NCS)4] в слабокислой среде образует с ионами цинка бесцветный осадок в виде характерных кристаллов:
ZnCl2 + (NH4)2[Hg(NCS)4] → Zn[Hg(NCS)4]↓ + 2 NH4Cl
В присутствии незначительной примеси соли кобальта могут выпадать голубоватые смешанные кристаллы состава Zn[Hg(NCS)4] и Со[Hg(NCS)4], которые в отсутствие ионов цинка не образуются. Из более концентрированных растворов солей кобальта осадок Co[Hg(NCS)4] выпадает быстро и в отсутствие ионов Zn2+. Осадок Zn[Hg(NCS)4] растворяется в сильных кислотах и разлагается щелочами с образованием желтого осадка HgO.
Проведению реакции мешают ионы железа (III), никеля, кобальта, меди.
Выполнение опыта:
Взять предметное стекло, подложить чёрную бумагу под стекло, на стекло поместить каплю испытуемого раствора, подкисленного серной кислотой и каплю раствора реактива тетрароданомеркуриата (II) аммония (NH4)2[Hg(NCS)4]. Наблюдать под микроскопом характерные перистые кристаллы. Зарисовать наблюдения в тетрадь.
4.3. Реакции катиона хрома (III) Cr3+
Опыт 4.3.1. Действие щелочей (группового реагента)
Гидроксиды натрия и калия осаждают ионы Cr3+ в виде гидроксида Cr(OH)3 серо-зеленого цвета, который растворяется в избытке щелочи с образованием зеленого раствора тетра- или гексагидроксохромата (III).
Cr3+ + 3OH- → Cr(OH)3¯
Cr(OH)3 ¯ + OH- → [Cr(OH)4]-
Выполнение опыта:
Поместить в пробирку 2-3 капли раствора соли хрома (III) и прибавить 6-7 капель 2 М раствора NaOH до образования зеленого раствора гидроксокомплекса хрома (III). Если осадок не выпал, пробирку необходимо нагреть. Пробирку с содержимым разделить на 2 части и оставить для следующих опытов.
Записать наблюдение и уравнения реакций.
Опыт 4.3.2. Реакция с пероксидом водорода в щелочной среде
Ионы Cr3+ в избытке щелочи окисляются пероксидом водорода Н2О2 до хромат-ионов CrO42- желтого цвета:
2Cr3+ + 10OH- + 3Н2О2 → 2CrO42- + 8Н2О
Выполнение опыта:
К полученному в предыдущем опыте раствору прибавить 3-4 капли 10% раствора Н2О2 и нагреть смесь на водяной бане в течение 2-3 минут. Окрашивание раствора в желтый цвет свидетельствует об образовании иона CrO42-.
Записать наблюдения и уравнения реакций. Рассмотреть окислительно-восстановительную реакцию с помощью метода электронного баланса.
Опыт 4.3.3. Реакция с раствором аммиака
Катионы Cr3+ с раствором аммиака образуют осадок гидроксида хрома (III) Cr(OH)3 серо-зеленого или сине-фиолетового цвета:
Cr3+ + 3NH3•H2O → Cr(OH)3 + 3NH4+
Cr3+ + 3OH- → Cr(OH)3¯
Осадок Cr(OH)3, обладающий амфотерными свойствами, растворяется как в щелочах, так и в кислотах:
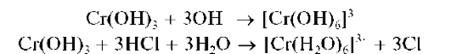
В растворе аммиака гидроксид хрома (III) растворяется лишь частично с образованием фиолетового комплекса [Cr(NH3)6]3+:
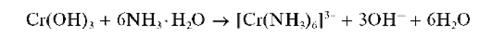
Выполнение опыта:
В пробирку внести несколько капель соли хрома (III), прибавить по каплям раствор аммиака до выпадения серо-зеленого (или сине-фиолетового) осадка. Добавление (по каплям) в пробирку раствора аммиака приводит к частичному растворению осадка. Раствор над осадком становится фиолетовым.
Записать наблюдения и уравнения реакций в тетрадь.
Опыт 4.3.4. Реакцияс персульфатом аммония
Наиболее характерной и в то же время специфической реакцией на катионы хрома является реакцией окисления Cr3+ до хромат- и дихромат ионов в кислой и щелочной среде.
Окисление иона Cr3+ в кислой среде действием персульфата аммония (NH4)2S2O8 (в присутствии катализатора AgNO3) позволяет получить ион Сr2О72– , который имеет желто-оранжевую окраску:
Cr(NO3)3 + 3(NH4)2S2O8 + 7H2O → H2Сr2О7 +6H2SO4 + 6NH4NO3.
2Cr3+ + 3S2O82– + 7H2O → Cr2O72– + 6SO42– + 14H+
В кислой среде реакция идёт только при нагревании при избытке реагента и в присутствие катализатора (AgNO3 или смеси Ca(NO2)3, Hg(NO2)3 и Ni(NO2)3).
Идентификацию CrO42– и Cr2O72– проводят по реакции образования надхромовых кислот с последующей их экстракцией амиловым спиртом.
Выполнение опыта:
В пробирку поместить раствор, содержащий ионы Cr3+ (но не хлорида, так как хлорид-ионы также окисляются!), 5 капель 2М H2SO4, небольшое количество персульфата аммония (сухого) и 1-2 капли AgNO3. Раствор нагреть до кипения. Появление желтой окраски указывает на присутствие ионов Cr3+. Оставить пробирку с содержимым для выполнения следующего опыта.
Записать наблюдения и уравнения реакций в тетрадь. Рассмотреть окислительно-восстановительную реакцию с помощью метода электронного баланса.
Опыт 4.3.5. Образование перекиси хрома CrO5
При действии перекиси водорода Н2О2 на подкисленный раствор дихромат-иона образуется пероксокислота (надхромовая) синего цвета:
Сr2О72– + 4Н2О2 + 2Н+ → 2СrO5 + 3Н2О.
Перекись хрома легко разлагается в водном растворе до Сr3+, окрашивающий раствор в зеленый цвет, иО2, поэтому ее экстрагируют органическим растворителем (диэтиловым эфиром, изоамиловым спиртом и др.), в котором она более устойчива, чем в воде. Реакцию необходимо вести без нагревания. При выполнении реакции должны отсутствовать другие окислители. Реакция очень специфична и используется как проверочная при определении Сr3+. Реакция высокочувствительна: предел обнаружения - 2,5 мкг.
Выполнение опыта:
Раствор, полученный в предыдущем опыте охладить, добавить к нему 10 капель амилового спирта, 3- 4 капли перекиси водорода и встряхнуть. В присутствии хрома слой органического растворителя окрашивается в синий цвет вследствие образования перекиси хрома.
Записать наблюдения и уравнения реакций в тетрадь.
Опыт 4.3.6. Окисление перманганатом калия
Перманганат калия KMnO4 в сернокислой среде при нагревании окисляет катион Cr3+ до дихромат-иона, что можно описать схемой:
10Cr3+ + 6MnO4 – + 11H2O → 5Cr2O72– + 6Mn2+ + 22H+ (кислая среда)
Раствор окрашивается в желто-оранжевый цвет. При прибавлении избытка раствора перманганата калия окисляется катион марганца (II) Mn2+ и выделяется бурый осадок MnO(OH)2:
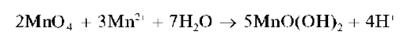
Увеличение кислотности среды препятствует образованию осадка MnO(OH)2.
В щелочной среде окисление хрома (III) также может происходить под действием перманганата калия:
Cr3+ + MnO4– + 4OH– → CrO42– + MnO2 + 2H2O (щелочная среда)
Выполнение опыта:
В пробирку внести 3-4 капли раствора сульфата или нитрата (но не хлорида!) хрома (III), 3-4 капли раствора серной кислоты, смесь нагреть и прибавить к ней по каплям раствор перманганата калия KMnO4 до приобретения раствором желто-оранжевой окраски. При дальнейшем прибавлении раствора KMnO4 выпадает бурый осадок MnO(OH)2.
Записать наблюдения и уравнения реакций в тетрадь. Рассмотреть окислительно-восстановительную реакцию с помощью метода электронного баланса.
Дата добавления: 2020-11-18; просмотров: 1500;











