Опыт 4.4.4. Реакция с соединениями висмута
Стандартный окислительно-восстановительный потенциал пары Sn4+/Sn2+ равен +0,15В. Следовательно Sn2+ является довольно сильным восстановителем.
Соединения висмута (Ш) восстанавливаются солями олова (II) в щелочной среде до металлического висмута:
3Na2SnO2 + 2Bi(OH)3 → 2Вi↓+ 3Na2SnO3 + 3Н2О
3 SnO22– + 2Bi(OH)3 → 2Bi↓ + 3SnO32– + 3Н2О или
Sn2+ + 4 OH– → Sn(ОН)42–
Sn(OH)42– + Bi(OH)3 → Bi↓ + Sn(OH)62– + OH–
Образование черного осадка металлического висмута свидетельствует о наличии в растворе иона Sn2+.
Выполнение опыта:
Приготовить в пробирке раствор станнита натрия Na2SnO2. Для этого к 2–3 каплям 1 Мраствора SnCl2 прибавить 8 –10 капель 2Мраствора NaOH (на холоде) до растворения первоначально выпавшего осадка Sn(OH)2 с образованием станнита. К полученному раствору прибавить 2–3 капли раствора соли висмута (III), перемешать. Выпадает черный осадок металлического висмута и образуется станнат натрия.
Записать наблюдения и уравнения реакций в тетрадь. Рассмотреть окислительно-восстановительную реакцию с помощью метода электронного баланса.
Опыт 4.4.5. Реакция с хлоридом ртути (II)
Олово (II) восстанавливает соединения ртути (II) до металлической ртути, выделяющейся, как и металлический висмут, в виде черного осадка. Реакция протекает в две стадии. Вначале ртуть (II) восстанавливается до ртути (I), а затем - до металлической ртути:
2 Hg2+ + [SnIICl4]2– + 4 Cl– →Hg2Cl2↓ + [SnIVCl6]2–
Hg2Cl2 + [SnIICl4]2–→[SnIVCl6]2– + 2 Hg↓
Выполнение опыта:
В пробирку внести 3-5 капель солянокислого раствора хлорида олова (II) и прибавить 2-3 капли раствора хлорида ртути (II) - сулемы HgCl2. Выпадает белый осадок каломели Hg2Cl2, который постепенно чернеет за счет выделяющейся металлической ртути.
Записать наблюдения и уравнения реакций в тетрадь. Рассмотреть окислительно-восстановительные реакции с помощью метода электронного баланса.
Опыт 4.4.6. Реакция восстановления олова (IV) до олова (II)
Для восстановления олова (IV) до олова (II) можно применять различные восстановители. При восстановлении олова (IV) металлическим железом в солянокислой среде реакция протекает по схеме:
[SnCl6]2– + Fe →[SnCl4]2– + FeCl2
Олово (II), полученное после восстановления олова (IV), открывают реакциями с солями висмута (III), c хлоридом ртути (II) и др.
Выполнение опыта:
В пробирку внести 8-10 капель раствора соли олова (IV), 2-3 капли концентрированной соляной кислоты HCl, прибавить немного железных опилок или железных стружек и нагреть смесь до кипения. Через 3-5 минут отфильтровать оставшееся металлическое железо и в фильтрате открыть олово (II), как описано выше в предыдущих опытах.
Записать наблюдения и уравнения реакций в тетрадь. Рассмотреть окислительно-восстановительную реакцию с помощью метода электронного баланса.
4.5. Реакции катиона мышьяка As3+ (арсенит-иона AsO33-)
ВНИМАНИЕ! Все соединения мышьяка ядовиты!
При работе с ними необходимо проявлять особую осторожность!
Опыт 4.5.1. Реакция с хлоридом бария
Арсенит-ионы в аммиачной среде при взаимодействии с катионами бария образуют белый осадок арсенита бария Ba3(AsO3)2:
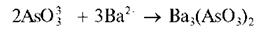
Выполнение опыта:
В пробирку внести 2- 3 капли раствора арсенита натрия Na3AsO3, 2 капли раствора аммиака и добавить по каплям раствор BaCl2 до прекращения образования белого осадка арсенита бария.
Записать наблюдения и уравнения реакций в тетрадь.
Опыт 4.5.2. Реакция с сульфид-ионами в кислой среде
Арсенит-ионы при реакциях с растворимыми сульфидами (натрия, аммония) образуют желтый осадок сульфида мышьяка (III) As2S3 только в сильнокислой среде:
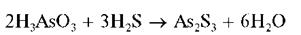
Из нейтральных или щелочных растворов осадок не выпадает. Осадок As2S3 нерастворим в HCl, но растворяется в растворах щелочей, аммиака, карбоната аммония при избытке сульфидов аммония или натрия с образованием тиосолей, например:
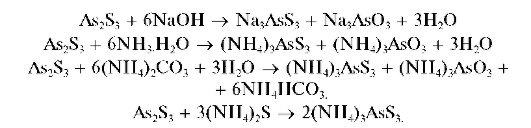
Реакция фармакопейная.
Выполнение опыта:
В пробирку внести 3-4 капли раствора арсенита натрия Na3AsO3, 4-5 капель раствора HCl и по каплям добавить раствор сульфида натрия Na2S или сероводородной воды. Выпадает желтый осадок сульфида мышьяка (III).
Записать наблюдения и уравнения реакций в тетрадь.
Опыт 4.5.3. Реакция с нитратом серебра
Арсениты образуют с нитратом серебра AgNO3 желтый аморфный осадок арсенита серебра Ag3AsO3:
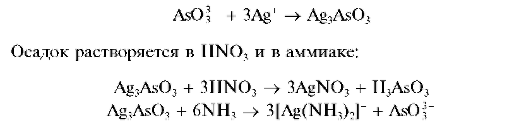
Реакция фармакопейная.
Выполнение опыта:
К 3-5 каплям раствора арсенита натрия Na3AsO3 прибавить по каплям раствор AgNO3. Выпадает желтый осадок.
Записать наблюдения и уравнения реакций в тетрадь.
Опыт 4.5.4. Реакция с йодом
Арсениты окисляются йодом I2 до арсенатов в нейтральной или слабощелочной среде (раствор йода обесцвечивается):
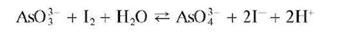
Реакция обратима. Для смещения равновесия вправо в раствор прибавляют твердый гидрокарбонат натрия NaHCO3, связывающий ионы водорода в слабую угольную кислоту.
Аналогично протекают реакции с хлорной и бромной водой, которые окисляют арсениты до арсенатов.
Выполнение опыта:
В пробирку внести 3-5 капель раствора Na3AsO3, прибавить небольшое количество твердого гидрокарбоната натрия NaHCO3 и добавить по каплям раствор йода, который обесцвечивается.
Записать наблюдения и уравнения реакций в тетрадь.
Опыт 4.5.5. Реакция с солями меди (II)
Арсениты или мышьяковистая кислота при реакциях с солями меди (II) в слабощелочной среде образуют желто-зеленый осадок арсенита меди Cu3(AsO3)2:
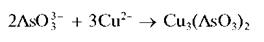
Осадок растворяется в избытке щелочи. При этом раствор окрашивается в синий цвет:
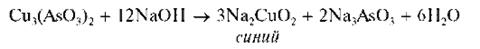
При кипячении этого синего щелочного раствора мышьяк (III) окисляется медью (II) до мышьяка (V), и из раствора выпадает красный осадок оксида меди (I) Cu2O:
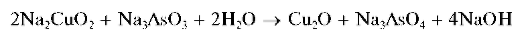
Реакцию используют для отличия соединений мышьяка (III) от соединений мышьяка (V).
Выполнение опыта:
В пробирку внести 3-4 капли разбавленного раствора сульфата меди (II) CuSO4, прибавить 1-2 капли 2 моль/лраствора NaOH и 2 капли раствора арсенита натрия Na3AsO3 или гидроарсенита натрия Na2HAsO3.
К смеси добавить по каплям при перемешивании раствор NaOH до растворения осадка и образования синего раствора. Последний осторожно нагреть до кипения и кипятить до прекращения выпадения красного осадка оксида меди (I).
Записать наблюдения и уравнения реакций в тетрадь.
Опыт 4.5.6. Реакция восстановления соединений мышьяка до арсина AsH3
Небольшие количества арсенитов, арсенатов или других соединений мышьяка (при содержании ~ 0,001-0,1 мг мышьяка) открывают очень чувствительной реакцией восстановления соединений мышьяка до газообразного арсина AsH3, который идентифицируют реакциями с азотнокислым серебром AgNO3 или хлоридом ртути (II) HgCl2. Реакцию получения AsH3 проводят в кислой среде (H2SO4 или HCl). В качестве восстановителя часто выступает металлический цинк (точнее - водород в момент выделения, образующийся при растворении металлического цинка в кислотах):
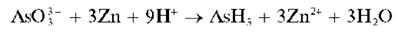
Вместо металлического цинка иногда используют металлический магний (а также алюминий - в щелочной среде).
Выделяющийся газообразный арсин AsH3 при взаимодействии с AgNO3 образует вначале соединение состава AsAg6(NO3)3 желтого цвета:
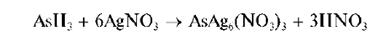
Затем темнеющее вследствие разложения с выделением тонкодисперсного металлического серебра:
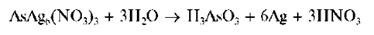
При взаимодействии AsH3 с хлоридом ртути (II) HgCl2 вначале образуется желто-оранжевый продукт реакции состава As(HgCl)3Hg2Cl2, который под воздействием влаги изменяет окраску на бурую из-за разложения с выделением свободного мышьяка As (и Hg2Cl2).
Мешают сульфиды, соединения сурьмы, фосфора, окислители.
Реакция фармакопейная.
Выполнение опыта:
Арсин очень ядовит! Реакции проводят только под тягой!
В чистуюпробирку внести 1 млраствора H2SO4 (или 10% раствора HCl), немного (кусочек) металлического цинка и прибавить 3-4 капли разбавленного раствора Na3AsO3 (или NaH2AsO3).
Для поглощения возможных мешающих примесей сероводорода в верхнюю часть пробирки помещают вату, пропитанную раствором ацетата свинца (CH3COO)2Pb. При наличии сероводорода в парах вата чернеет за счет образования черного сульфида свинца.
Отверстие пробирки покрывают фильтровальной бумагой, смоченной раствором AgNO3. Через 3- 4 мин после начала реакции на бумаге возникает бурое или черное пятно.
Если вместо бумаги, пропитанной AgNO3, использовать фильтровальную бумагу, смоченную спиртовым раствором HgCl2 (фармакопейная реакция), то на бумаге появится желто-бурое пятно.
Записать наблюдения и уравнения реакций в тетрадь.
4.6. Реакции катиона мышьяка As5+ (арсенат-иона AsO43-)
ВНИМАНИЕ! Все соединения мышьяка ядовиты!
При работе с ними необходимо проявлять особую осторожность!
Опыт 4.6.1. Реакция с хлоридом бария
Арсенат-ион AsO43- образует с катионами бария в аммиачной среде белый осадок арсената бария Ba3(AsO4)2:
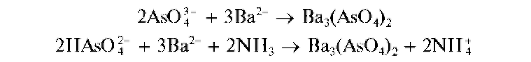
Осадок арсената бария растворяется в минеральных кислотах и в уксусной кислоте.
Выполнение опыта:
В пробирку внести 3-5 капель раствора арсената натрия, 2 капли раствора аммиака и прибавить по каплям раствор хлорида бария до прекращения выпадения белого осадка арсената бария.
Записать наблюдения и уравнения реакций в тетрадь.
Опыт 4.6.2. Реакция с нитратом серебра
Арсенаты образуют с нитратом серебра AgNO3 аморфный осадок арсената серебра Ag3AsO4 шоколадного цвета:
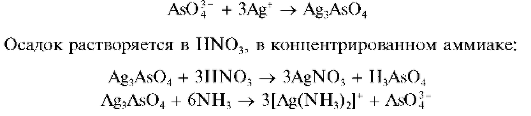
Реакция фармакопейная.
Выполнение опыта:
К 3- 5 каплям раствора арсената натрия в пробирке прибавить по каплям раствор AgNO3 до выпадения осадка шоколадного цвета.
Записать наблюдения и уравнения реакций в тетрадь.
Опыт 4.6.3. Реакция с магнезиальной смесью
Арсенат-ион с магнезиальной смесью (аммиачный раствор MgSO4 и NH4Cl) медленно образует белый мелкокристаллический осадок магний-аммоний арсената NH4MgAsO4:
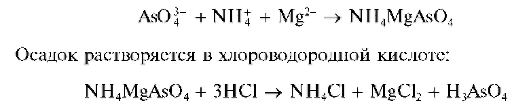
Мешают фосфат-ионы. C арсенит-ионами осадок не образуется.
Реакция фармакопейная.
Выполнение опыта:
В пробирку внести 3-5 капель раствора арсената натрия Na3AsO4 или гидроарсената натрия Na2HAsO4 и такой же объем магнезиальной смеси (или же 2-3 капли раствора MgSO4, 1-2 капли раствора аммиака и 4-5 капель раствора NH4Cl). Пробирку встряхнуть, стенки пробирки потереть стеклянной палочкой. Медленно образуется белый мелкокристаллический осадок.
Реакцию можно проводить и как микрокристаллоскопическую.
Поместить каплю осадка на предметное стекло и рассмотреть в микроскоп.
Записать наблюдения и уравнения реакций в тетрадь.
Опыт 4.6.4. Реакция с сульфидами или сероводородной водой
Арсенаты при взаимодействии с сульфид-ионами S2- в сильнокислой среде образуют желтый аморфный осадок сульфида мышьяка (V) As2S5:
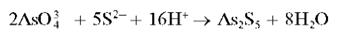
Для смещения равновесия вправо реакцию проводят при большом избытке ионов водорода (в среде концентрированной HCl).
Осадок растворяется в растворах сульфида аммония (NH4)2S, аммиака, карбоната аммония (NH4)2CO3, в щелочах, в концентрированной азотной кислоте, но не растворяется в хлороводородной кислоте.
Реакция фармакопейная.
Выполнение опыта:
В пробирку внести 3-5 капель раствора арсената натрия, прибавить 3-5 капель раствора концентрированной HCl и ввести по каплям раствор сульфида аммония или сероводородную воду до выпадения желтого осадка.
Записать наблюдения и уравнения реакций в тетрадь.
Опыт 4.6.5. Реакция с молибдатом аммония
Арсенат-ионы образуют с молибдатом аммония (NH4)2MoO4 в азотнокислой среде (рН < 1) при нагревании желтый кристаллический осадок аммонийной соли мышьяково-молибденовой кислоты состава (NH4)3[AsO4(MoO3)12]:
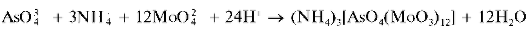
Осадок растворяется в щелочах, но не растворяется в HNO3. Мешают фосфат-ионы, дающие аналогичный осадок. Арсениты осадка не дают. Чувствительность реакции возрастает в присутствии NH4NO3.
Современные исследования показали, что в водных растворах молибдат аммония не существует, а превращается в результате реакции гидролиза и полимеризацией молибдат-иона в разные полимолибдаты, например, парамолибдат аммония (NH4)6Mo7O24.
Выполнение опыта:
Первый вариант. В микротигель внеси 3 капли раствора арсената натрия, содержимое тигля выпарить досуха. К остатку прибавить 3 капли концентрированной HNO3 и упарить смесь до получения влажного остатка. Прибавить 5 капель раствора молибдата аммония, смесь перемешать и перенести в центрифужную пробирку или отфильтровать. После центрифугирования получают желтый кристаллический осадок.
Второй вариант. В пробирку внести 2-3 капли раствора арсената натрия, прибавить 10-15 капель раствора молибденового реагента (раствор (NH4)2MoO4 и NH4NO3 в HNO3) и нагревать смесь несколько минут на водяной бане до выпадения желтого кристаллического осадка.
Записать наблюдения и уравнения реакций в тетрадь.
Опыт 4.6.6. Реакция с йодидами
Арсенат-ион при взаимодействии в кислой среде с йодид-ионами I- восстанавливается до арсенит-иона AsO33- с выделением йода, окрашивающего раствор в желтый цвет:
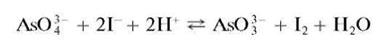
В присутствии крахмала раствор окрашивается в синий цвет. Поскольку реакция обратима, то для смещения равновесия вправо ее проводят при избытке ионов водорода - в среде концентрированной HCl.
Мешают окислители (например, NO2-, NO3- и др.).
Чувствительность реакции повышается при экстрагировании выделяющегося йода органическим растворителем (толуолом, тетрахлоридом углерода и т.д.).
Выполнение опыта:
В пробирку внести 3-5 капель раствора гидроарсената натрия Na2HAsO4, прибавить 1-2 капли концентрированной HCl, 3-4 капли раствора йодида калия KI и 2-3 капли раствора крахмала. Раствор окрашивается в синий цвет.
Записать наблюдения и уравнения реакций в тетрадь. Рассмотреть окислительно-восстановительную реакцию с помощью метода электронного баланса.
Опыт 4.6.6. Окрашивание пламени соединениями мышьяка(III и V)
При внесении соединений мышьяка (Ш) или мышьяка (V) в пламя газовой горелки оно окрашивается в голубой цвет.
Выполнение опыта:
Взять проволоку, убедиться, что она чистая, для чего внести ее в пламя спиртовки. Если пламя не окрашивается, можно проводить реакцию на обнаружение ионов. Если окрашивается, то проволоку следует очистить, обработав концентрированной соляной кислотой и прокалив в пламени спиртовки до исчезновения окрашивания пламени.
Обмакнуть очищенную проволоку в пробирку с раствором соли или сухую соль мышьяка (III) и внести ее в пламя спиртовки. Пламя окрасится в характерный голубой цвет.
Повторить опыт с солями мышьяка (V).
Записать наблюдения в тетрадь.
Контрольная задача4.
Дата добавления: 2020-11-18; просмотров: 1276;











