Общая характеристика катионов четвертой группы
Для катионов IV группы, за исключением Zn2+ и Al3+, характерна переменная степень окисления Cr (III) и Cr (VI), Sn (II) и Sn (IV).
Многие элементы этой группы катионов расположены в середине 4-го большого периода периодической системы Д.И. Менделеева и представляют собой переходные элементы, совмещающие свойства металлов и неметаллов. Таковы, например, цинк, хром, олово, их гидроксиды обладают амфотерными свойствами.
Так как основания катионов четвертой группы являются слабыми, то все соли этих катионов подвергаются гидролизу. Малорастворимые гидроксиды катионов IV группы растворимы в избытке сильных оснований.
У катионов четвертой группы резко выражена способность к комплексообразованию, окислительно-восстановительным процессам.
Растворы большинства солей катионов данной группы имеют характерную окраску. Сульфаты, хлориды, нитраты и нитриты, образованные катионами четвертой группы, растворимы в воде. Малорастворимы карбонаты, фосфаты и сульфиды.
Растворы солей цинка и алюминия бесцветны и имеют в результате гидролиза кислую реакцию среды. К малорастворимым соединениям относятся гидроксиды, фосфаты, сульфиды и др.
Растворы солей хрома окрашены: растворимые соли хрома (III) имеют окраску от зеленой до фиолетовой, ионы хрома (VI) образуют в щелочной среде анионы CrO42– желтого цвета и в кислой среде анионы Cr2O72– оранжевого цвета. Из соединений хрома (III) малорастворимы гидроксиды, фосфаты, из соединений хрома (VI) малорастворимы хроматы бария, свинца, серебра, висмута, ртути и т.д.
Гидроксипроизводные иона Sn(II) обладают преимущественно основными свойствами. Тем не менее, они заметно гидролизуются в водных растворах и могут образовывать станниты (например, Na2[Sn(OH)4]). Гидроксипроизводные иона Sn(IV) амфотерны, при действии избытка щелочи образуются станнаты (например, Na2[Sn(OH)6]). Соли олова (II) и олова (IV) хорошо растворяются в растворах соляной кислоты с образованием комплексных ионов [SnCl4]2– и [SnCl6]2–. Растворы солей олова, а также большинство малорастворимых соединений (гидроксиды, основные соли и кислоты) бесцветны. Характерную окраску имеют сульфиды олова: сульфид олова (II) — темно-коричневый, а сульфид олова (IV) — желтый.
При рассмотрении катионов четвертой аналитической группы мы-шьяк (III) и мышьяк (V) считают катионами As3+ и As5+ условно,так как в водных средах соответствующие соединения присутствуют обычно не в форме указанных катионов, а в форме анионов - арсенит-ионов AsO33-или AsO2 - - анионов ортомышьяковистой H3AsO3 или метамы-шьяковистой HAsO2 кислот, и арсенат-ионов AsO43-- анионов мышьяковой кислоты H3AsO4. В концентрированных растворах хлороводородной кислоты существуют комплексные анионы [AsCl4]- и [AsCl6]-.
Даже если исходное вещество и содержало формально мышьяк в виде катионов, например, AsCl3,As2O3,As2O5 и т.д., то в водной среде оно гидролизуется с дальнейшим образованием анионной формы мышьяка (III) или мышьяка (V):
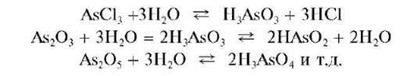
В соответствии с изложенным при проведении анализа по кислотно-основному методу обычно используют аналитические реакции на арсенитили арсенат-анионы, а не на катионы мышьяка (III) или мышьяка (V).
Действие группового реагента. Групповым реагентом на IV группу катионов является 2М раствор гидроксида натрия в присутствии пероксида водорода. В этом случае все ионы переменной степени окисления находятся в высшей степени окисления.
При действии эквивалентных количеств гидроксидов натрия или калия на катионы IV аналитической группы образуются осадки бесцветных гидроксидов цинка, алюминия, олова, а также серо-зеленый гидроксид хрома.
ZnCl2 + 2 NaOH→ Zn(OH)2↓ + 2 NaCl
CrCl3 + 3 NaOH →Cr(OH)3↓ + 3 NaCl
AlCl3 + 3 NaOH →Al(OH)3↓ + 3 NaCl
SnCl2 + 2 NaOH→ Sn(OH)2↓ + 2 NaCl
SnCl4 + 4 NaOH →Sn(OH)4↓ + 4 NaCl
Все гидроксиды имеют амфотерный характер и растворимы в избытке щелочей:
Zn(OH)2 + 2 NaOH →Na2[Zn(OH)4]
Cr(OH)3 + NaOH →Na[Cr(OH)4]
Al(OH)3 + NaOH →Na[Al(OH)4]
Sn(OH)2 + 2 NaOH→ Na2[Sn(OH)4]
Sn(OH)4 + 2 NaOH →Na2[Sn(OH)6]
Гидроксиды также растворимы в избытке кислот:
Zn(OH)2 + 2 HCl→ ZnCl2 + 2 H2O
Cr(OH)3 + 3 HCl →CrCl3 + 3 H2O
Al(OH)3 + 3 HCl →AlCl3 + 3 H2O
Sn(OH)4 + 6 HCl →H2[SnCl6] + 4 H2O
Реакция с раствором NH3. При действии растворов аммиака на раствор катионов IV аналитической группы также образуются осадки гидроксидов алюминия, олова, хрома. Ионы цинка в избытке аммиака растворяются с образованием комплексных ионов [Zn(NH3)4]2+ и [Zn(NH3)6]2+. Положение равновесия между этими двумя комплексными ионами зависит от концентрации аммиака в растворе.
Реакция с сульфидом аммония. Сульфид аммония (NH4)2S с катионами Zn2+ образует нерастворимые в воде сульфиды, а с катионами Аl3+ и Cr3+ – нерастворимые в воде гидроксиды.
Zn2+ + (NH4)2S = ZnS↓ + 2NH4+
2Al3+ + 3(NH4)2S + 6H2O = 3H2S↑ + 2Al(OH)3↓ + 6NH4+
2Cr3+ + 3(NH4)2S + 6H2O = 3H2S↑+ 2Cr(OH)3↓ + 6NH4+
Условия осаждения данных катионов следующие. Осаждение ведут в присутствии гидроксида аммония NH4OH, для подавления гидролиза сульфида аммония и образования кислых солей.
| (NH4)2S + HOH | D | NH4HS + NH4OH |
> [NH4OH]
|
С целью предупреждения образования коллоидных растворов, осаждают при нагревании и в присутствии электролита-коагулятора NH4Cl. Для поддержания постоянной реакции среды (рН) при осаждении амфотерных гидроксидов Al(OH)3 и Cr(OH)3 ведут в присутствии аммиачной буферной смеси (NH4OH и NH4Cl). Именно такая смесь используется не случайно, так как один из ее компонентов подавляет гидролиз (NH4)2S, а другой – является электролитом-коагулятором.
Таблица 4.1
Дата добавления: 2020-11-18; просмотров: 1451;











