Энергетика химических реакций. Химическая кинетика. Теория активированного комплекса. Катализ. Цепные реакции
При химических реакциях изменяется электронная энергия 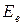 молекул или отдельных атомов, то есть энергия, обусловленная движением электронов и их взаимодействием друг с другом и с атомными ядрами. Энергия атомных ядер в химических реакциях не изменяется.
молекул или отдельных атомов, то есть энергия, обусловленная движением электронов и их взаимодействием друг с другом и с атомными ядрами. Энергия атомных ядер в химических реакциях не изменяется.
Если суммарная электронная энергия исходных продуктов реакции больше, чем суммарная электронная энергия конечных продуктов, то есть 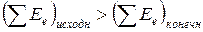 , то избыточная энергия выделяется в виде тепла или энергии светового излучения (люминесценция) или кинетической механической энергии продуктов реакции (взрыв). Это – экзотермические реакции. Если
, то избыточная энергия выделяется в виде тепла или энергии светового излучения (люминесценция) или кинетической механической энергии продуктов реакции (взрыв). Это – экзотермические реакции. Если 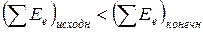 , то при протекании реакции происходит поглощение недостающей энергии: тепловой или лучистой. Это – эндотермические реакции.
, то при протекании реакции происходит поглощение недостающей энергии: тепловой или лучистой. Это – эндотермические реакции.
Количество теплоты, выделяемой (поглощаемой) при реакции, - тепловой эффект реакции. Основоположник термохимии - учения о тепловых эффектах химических реакций – Г.И. Гесс (росс., 19 век). Примеры термохимических уравнений:
- экзотермическая реакция: H2 + ½ O2 = H2O + 285.8 кДж/моль;
- эндотермическая реакция: 3/2 O2 = O3 (озон) – 142 кДж/моль.
Учение о скоростях и механизмах химических реакций, о возможностях управления скоростями реакций – химическая кинетика. Ее основы заложили во второй половине 19-го века Н.А. Меншуткин (росс.), Я. Вант-Гофф (голл.), С. Аррениус (швед.).
Рассмотрим гомогенную (однородную) реакцию, то есть реакцию, протекающую в некотором объеме, где равномерно распределены исходные вещества. Скорость 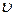 гомогенной реакции есть количество вещества, вступившего в реакцию или образовавшегося при ней за единицу времени в единице объема:
гомогенной реакции есть количество вещества, вступившего в реакцию или образовавшегося при ней за единицу времени в единице объема:
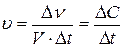 , (13.2)
, (13.2)
где 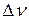 - количество вещества (измеряется в молях), вступившего в реакцию или образовавшегося при ней в объеме V за время
- количество вещества (измеряется в молях), вступившего в реакцию или образовавшегося при ней в объеме V за время 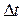 ,
, 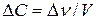 - изменение молярной концентрации вещества.
- изменение молярной концентрации вещества.
Скорость реакции возрастает при увеличении концентраций исходных веществ. Действительно, чтобы произошел элементарный акт химического взаимодействия, нужно, чтобы молекулы исходных веществ вступили в контакт, а частота контактов увеличивается с ростом концентрации этих веществ. Рассмотрим реакцию, в которую вступают по одной молекуле двух исходных веществ: А + В = С. Скорость такой реакции пропорциональна как концентрации С(А) вещества А, так и концентрации С(В) вещества В, то есть
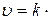 С(А)·С(В), (13.3)
С(А)·С(В), (13.3)
где k – константа скорости реакции, численно равная скорости реакции при концентрациях C(A)=C(B)=1 моль/л, зависящая от условий реакции и от того, какие вещества реагируют, но не от их концентраций
Для реакций вида А + В + … + D = E, в которые вступают по одной молекуле более, чем двух веществ, формула скорости реакции аналогична (13.3):
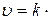 С(А)·С(В)·…·С(D). (13.4)
С(А)·С(В)·…·С(D). (13.4)
Реакцию 2 А + В = С, в которую вступают две молекулы одного из исходных веществ, можно рассматривать как реакцию А + А + В = С, тогда в соответствии с формулой (13.4) ее скорость так зависит от концентраций:
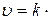 С(А)·С(А)·С(В) = k·C(А)2·С(В). (13.5)
С(А)·С(А)·С(В) = k·C(А)2·С(В). (13.5)
Уравнение реакции общего типа, в которую вступает по несколько молекул каждого из исходных веществ, имеет вид a·А + b·В + … + d·D = E. По аналогии с формулой (13.5) скорость такой реакции зависит от концентраций исходных продуктов следующим образом
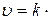 C(А)a·С(В)b·…·C(D)d. (13.6)
C(А)a·С(В)b·…·C(D)d. (13.6)
Формула (13.6) выражает закон действующих масс: скорость гомогенной реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных соответствующим коэффициентам в уравнении реакции.
Для протекания химической реакции нужно, чтобы молекулы исходных продуктов сталкивались между собой, и энергия их движения превышала некоторое пороговое значение, называемое энергией активации данной реакции 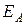 . Так как при повышении температуры возрастает количество молекул, имеющих необходимую энергию, то при этом увеличивается и скорость протекания реакции.
. Так как при повышении температуры возрастает количество молекул, имеющих необходимую энергию, то при этом увеличивается и скорость протекания реакции.
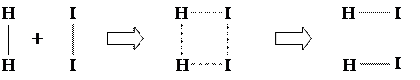 Наличие энергетического порога химической реакции объясняет теория активированного комплекса: образование новых молекул при соударении исходных происходит через промежуточное состояние активированного комплекса, в котором старые связи ослаблены и возникают новые связи. Рассмотрим, например, реакцию между молекулами йода и водорода с образованием молекул иодистого водорода: H2 + I2 = 2 HI. При этом система проходит через стадию активированного комплекса, показанную на следующей схеме, где сплошными линиями изображены стабильные связи, а пунктирными – перестраивающиеся:
Наличие энергетического порога химической реакции объясняет теория активированного комплекса: образование новых молекул при соударении исходных происходит через промежуточное состояние активированного комплекса, в котором старые связи ослаблены и возникают новые связи. Рассмотрим, например, реакцию между молекулами йода и водорода с образованием молекул иодистого водорода: H2 + I2 = 2 HI. При этом система проходит через стадию активированного комплекса, показанную на следующей схеме, где сплошными линиями изображены стабильные связи, а пунктирными – перестраивающиеся:
Время жизни активированного комплекса очень мало – примерно 10-13 с. В этом промежуточном состоянии потенциальная энергия системы больше, чем в исходном и в конечном состояниях. На рисунке 13.3 показано изменение потенциальной энергии системы в ходе экзотермической реакции.
 |
Рисунок 13.3 – Изменение потенциальной электронной энергии системы в ходе реакции. 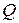 - тепловой эффект реакции,
- тепловой эффект реакции, 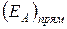 и
и 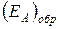 - энергии активации прямой и обратной реакций, соответственно. На стадии активированного комплекса пунктиром показана энергия системы в присутствии катализатора.
- энергии активации прямой и обратной реакций, соответственно. На стадии активированного комплекса пунктиром показана энергия системы в присутствии катализатора.
Из рисунка 13.3 видно что, наряду с превращением исходных веществ в конечные (прямая реакция), возможна и обратная реакция превращения конечных продуктов в исходные вещества. На рисунке 13.3 представлена ситуация, когда энергия активации обратной реакции больше энергии активации прямой реакции. При этом скорость прямой реакции будет больше, чем обратной. Если различие скоростей становится очень большим, то можно считать, что реакция протекает только в одном направлении.
Скорость реакции можно изменить при наличии катализатора - вещества, которое изменяет скорость реакции, но само в ходе реакции не расходуется. Действие ускоряющего реакцию катализатора объясняется, как показано на рисунке 13.3, снижением в его присутствии энергии активированного комплекса, то есть уменьшением энергии активации реакции. Катализаторы, замедляющие реакцию, называют ингибиторами. В биологии важную роль играют автокаталитические реакции, при которых один из продуктов реакции сам является катализатором этой реакции.
В обычных реакциях каждый элементарный акт взаимодействия молекул не зависит от предшествующих. В цепных реакциях возможность каждого элементарного акта зависит от результатов предыдущего и определяет возможность последующего. В цепных реакциях участвуют свободные радикалы (активные центры), то есть атомы или группы атомов, обладающие неспаренными электронами и поэтому имеющие высокую реакционную спо-
 |
собность. Например, свободные атомы водорода Н•, кислорода или хло-
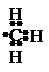 | |||||
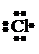 | |||||
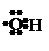 | |||||
ра , (упрощенное обозначение: •О•, Cl•), или группы ,
(упрощенное обозначение: •OH, •СН3).
Пример цепной реакции: смесь Н2 и Cl2 при освещении быстро реагирует с образованием HCl. Первый этап этой реакции – образование активного центра - диссоциация молекулы Cl2 под действием света (при условии, что энергия фотона 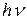 больше энергии связи этой молекулы): Cl2 +
больше энергии связи этой молекулы): Cl2 + 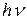 = 2 Cl•.
= 2 Cl•.
Следующий этап реакции – рост цепи: Cl• + H2 = HCl + H•,
H• + Cl2 = HCl + Cl•,
и так далее до 100 000 раз.
Третий, заключительный, этап реакции – обрыв цепи. Происходит рекомбинация радикалов, то есть связывание их в молекулу: H• + •H = H2,
H• + •Cl = HCl,
Cl• + •Cl = Cl2.
Дата добавления: 2020-10-25; просмотров: 507;











