Важнейшие классы неорганических веществ
Все вещества традиционно разделяют на органические и неорганические. К органическим относят углеводороды и их производные; многие органические вещества связаны с жизнедеятельностью организмов. К неорганическим относят остальные вещества, включая некоторые простые соединения углерода: оксиды СО, СО2, угольную кислоту Н2СО3, синильную кислоту HCN, соли этих кислот и др.
Неорганические вещества классифицируются либо по составу (например, бинарные, то есть двухэлементные, соединения, многоэлементные соединения и др.), либо по химическим свойствам (функциональным признакам), то есть по тому, какие функции выполняют эти вещества в химических реакциях.
Пример бинарных соединений - оксиды – соединения элементов с кислородом (N2O, CO, Al2O3, SO2 и множество других). Большинство оксидов относится к солеобразующим – при их взаимодействии с кислотами или основаниями образуются соли. Такие оксиды в свою очередь подразделяются на три группы.
Основные оксиды взаимодействуют с кислотами (и кислотными оксидами), образуя соли, например: СuО + 2 HCl = СаCl2 + H2O. К ним относятся оксиды щелочных и щелочноземельных металлов, а также CuO, FeO и др. Присоединяя (непосредственно или косвенно) воду, эти оксиды образуют гидроксиды, являющиеся основаниями.
Кислотные оксиды взаимодействуют с основаниями (и основными оксидами) с образованием солей, например: SO3 + 2 NaOH = Na2SO4 + H2O. К ним относятся СO2, SO2, SO3, SiO2, NO2, N2O5 и др. Присоединяя (непосредственно или косвенно) воду, эти оксиды образуют гидроксиды, являющиеся кислотами.
Амфотерные оксиды могут реагировать и с кислотами, и с основаниями, образуя соли, например: ZnO + 2 HCl = ZnCl2 + H2O, ZnO + 2 NaOH = = Na2ZnO2 + H2O. К таким оксидам относятся BeO, ZnO, Al2O3 и др. Соответствующие гидроксиды проявляют свойства как кислот, так и оснований.
Кроме солеобразующих, имеются несолеобразующие или безразличные оксиды, которым не соответствую никакие основания и кислоты, и которые не образуют солей, например, один из оксидов азота – NO.
Гидроксиды – представители многоэлементных соединений. Это вещества, содержащие одну или несколько отрицательно заряженных гидроксигрупп ―ОН. Гидроксиды либо возникают при соединении оксидов с водой, либо могут быть разложены на оксид и воду. Основные гидроксиды проявляют свойства оснований (NaOH, Ca(OH)2 и др.). Кислотные гидроксиды проявляют свойства кислот (HNO3, H2SO4 и др.). Существуют и амфотерные гидроксиды, которые в зависимости от условий могут проявлять себя как кислоты, так и как основания (например, Zn(OH)2 или Al(OH)3).
Важнейшими функциональными классами неорганических веществ являются основания, кислоты и соли.
Основания состоят из катионов (положительных ионов) металла и гид-
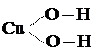 |
роксигрупп ―ОН, например: Na – O – H или
В молекулах оснований связи атомов кислорода с металлом менее прочны, чем связи с атомами водорода, поэтому в водных растворах основания распадаются (диссоциируют) с образованием гидроксильных ионов ОН– и положительных ионов металла.
Кислоты состоят из катионов водорода и анионов (отрицательных ионов) кислотного остатка. Они подразделяются на бескислородные и кислородсодержащие. Примеры структурных формул некоторых бескислородных кислот: H – Cl (хлороводород или соляная кислота), H – F (фтороводород или плавиковая кислота), H –C ≡ N (циановодород или синильная кислота). Примеры кислородсодержащих кислот и их структурных формул:
 |
В молекулах кислот одинарные связи атомов водорода с кислотными остатками менее прочны, чем прочие связи, поэтому в водных растворах кислоты диссоциируют с образованием положительных ионов водорода Н+ и отрицательных ионов кислотных остатков. Отметим, что ион Н+ есть ядро атома водорода, то есть просто протон.
В чистой воде часть молекул Н2О диссоциирует на ионы Н+ и ОН–, концентрации которых, очевидно, одинаковы и при нормальных условиях составляют С(Н+) = С(ОН–) = 10-7 моль/л. Добавление кислот увеличивает концентрацию ионов водорода С(Н+) и уменьшает концентрацию гидроксильных ионов С(ОН–). Следовательно, для кислот С(Н+) > 10-7 моль/л, а С(ОН–) < 10-7 моль/л. Добавление оснований, наоборот, увеличивает С(ОН–) и уменьшает С(Н+). Для оснований С(Н+) < 10-7 моль/л, а С(ОН–) > 10-7 моль/л.
Кислотность раствора характеризует водородный показатель рН, то есть десятичный логарифм концентрации ионов водорода, взятый со знаком «минус»:
pH = - lg C(H+). (13.1)
Для нейтральной среды, например, воды рН = 7, для кислой среды рН < 7, для щелочной среды рН > 7.
Соли – продукты замещения катионов водорода в кислоте на катионы металла. Образуются, например, при реакции нейтрализации кислоты и основания. Примеры реакции нейтрализации
Ca(OH)2 + H2SO4 = CaSO4 + 2 H2O;
NaOH + HNO3 = NaNO3 + H2O.
Названия солей бескислородных кислот имеют окончание –ид. Названия солей кислородсодержащих кислот в случае, если кислотообразующий элемент проявляет максимальную из возможных валентность или его валентность неизменна, имеют окончания –ат. Если кислотообразующий элемент проявляет меньшую валентность, то названия солей имеют окончания –ит. Этим правила образования названий солей не исчерпываются, но другие случаи здесь не рассматриваются. Некоторые наиболее важные для практики кислоты и названия их солей приведены в таблице 13.1.
Таблица 13.1 – Важнейшие неорганические кислоты и их соли
| Кислота | Формула | Соль |
| Азотная Азотистая Кремниевая Ортофосфорная Серная Сернистая Сероводород Угольная Хлороводород (соляная) Циановодород (синильная) | HNO3 HNO2 H2SiO3 H3PO4 H2SO4 H2SO3 H2S H2CO3 HCl HCN | Нитрат Нитрит Силикат Фосфат Сульфат Сульфит Сульфид Карбонат Хлорид Цианид |
Дата добавления: 2020-10-25; просмотров: 743;











