Необратимые и обратимые реакции. Химическое равновесие. Принцип Ле Шателье – Брауна
Как отмечалось в подразделе 13.3, любой прямой химической реакции соответствует обратная реакция. Если обратная реакция невозможна, то прямая реакция является необратимой и протекает до полного расходования одного из исходных веществ. Если скорости прямой реакции и соответствующей ей обратной реакции соизмеримы, то реакция является обратимой, и исходные вещества никогда не израсходуются полностью, так как будут вновь возникать в результате обратной реакции. Пример обратимой реакции – синтез аммиака NH3 из азота и водорода:
 N2 + 3 H2 2 NH3.
N2 + 3 H2 2 NH3.
Если вначале в реакторе будут находиться лишь азот и водород, то пойдет прямая реакция образования аммиака. Но при уменьшении концентраций исходных веществ и увеличении концентрации аммиака скорость прямой реакции  С(N2)·C(H2)3 снижается, а скорость обратной
С(N2)·C(H2)3 снижается, а скорость обратной 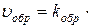 С(NH3)2 возрастает до тех пор, пока эти скорости не сравняются. Наступает состояние химического равновесия, в котором количества водорода, азота и аммиака остаются неизменными. Точно так же состояние химического равновесия наступит, если вначале в реакторе будет находиться аммиак, но в этом случае вначале преобладает обратная реакция, скорость которой постепенно снижается, а скорость прямой реакции нарастает. При постоянстве внешних условий состояние химического равновесия длится сколь угодно долго. При изменении условий равновесие нарушается, начинает преобладать либо прямая реакция (смещение равновесия вправо), либо обратная реакция (смещение равновесия влево), но спустя некоторое время равновесие вновь устанавливается при измененных значениях концентраций.
С(NH3)2 возрастает до тех пор, пока эти скорости не сравняются. Наступает состояние химического равновесия, в котором количества водорода, азота и аммиака остаются неизменными. Точно так же состояние химического равновесия наступит, если вначале в реакторе будет находиться аммиак, но в этом случае вначале преобладает обратная реакция, скорость которой постепенно снижается, а скорость прямой реакции нарастает. При постоянстве внешних условий состояние химического равновесия длится сколь угодно долго. При изменении условий равновесие нарушается, начинает преобладать либо прямая реакция (смещение равновесия вправо), либо обратная реакция (смещение равновесия влево), но спустя некоторое время равновесие вновь устанавливается при измененных значениях концентраций.
На примере реакции синтеза аммиака рассмотрим смещение равновесия при различных способах воздействия на систему.
Повысим концентрацию одного из компонентов, например азота. Увеличение C(N2) вызовет увеличение скорости прямой реакции, это приведет к снижению концентрации исходных веществ и увеличению концентрации конечного продукта – аммиака, это вызовет увеличение скорости обратной реакции и через некоторое время установится новое равновесие. Отметим, что смещение равновесия вызывает частичную компенсацию внешнего воздействия, то есть увеличения количества азота.
Подведем к реактору некоторое количество теплоты, пытаясь повысить температуру в нем. Реакция синтеза аммиака – экзотермическая, а обратная реакция разложения аммиака – эндотермическая. Поэтому подведение теплоты ускорит протекание обратной реакции – равновесие сместится влево, часть подведенного тепла израсходуется на разложение дополнительного количества аммиака, то есть опять же произойдет частичная компенсация внешнего воздействия.
Обобщением подобных примеров является принцип Ле Шателье – Брауна: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, чтобы частично или полностью скомпенсировать указанное воздействие.
Принцип Ле Шателье – Брауна применим не только к химическим, но и к физическим, биологическим и экологическим системам, то есть имеет большое значение для всего естествознания. Возможно, он позволяет объяснить и некоторые свойства экономических и социальных систем.
Рассмотрим для примера физическую систему: замкнутый резервуар - цилиндр с поршнем, в котором создан вакуум, а затем в него влито некоторое количество воды (см. рисунок 13.4).
Вода в резервуаре начинает испаряться, ее масса уменьшается и возрастает масса водяного пара. По мере увеличения концентрации молекул пара ускоряется обратный процесс конденсации, то есть превращения пара в воду. Если было влито достаточное количество воды, то наступит момент, когда скорости конденсации и испарения сравняются. В системе наступит состояние динамического равновесия, массы воды и пара перестанут изменяться, давление пара стабилизируется. Пар, находящийся в равновесии с водой, - насыщенный пар. При постоянстве внешних условий равновесие в системе «вода – насыщенный пар» будет длиться неограниченно долго.
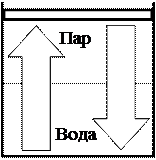
Рисунок 13.4 – Система «вода – пар» и протекающие в ней процессы.
Нарушим равновесие. Поддерживая температуру постоянной, опустим поршень, пытаясь повысить давление и концентрацию молекул насыщенного пара. Но это вызовет ускорение конденсации, уменьшение массы пара и увеличение массы воды. Через некоторое время равновесие восстановится при том же давлении насыщенного пара, но новых значениях масс пара и воды. То есть равновесие сместится так, чтобы скомпенсировать внешнее воздействие.
Сообщим системе некоторое количество теплоты, пытаясь повысить ее температуру. Тут же возрастет скорость испарения – процесса, требующего затраты тепловой энергии. Масса воды уменьшится, масса пара возрастет и вновь наступит равновесие, но при этом часть подведенной теплоты израсходуется на испарение дополнительного количества воды, то есть опять же произойдет частичная компенсация внешнего воздействия, как того требует принцип Ле Шателье – Брауна.
Рассмотрим модельную экологическую систему «добыча – хищники», часто условно называемую системой «зайцы – волки». При постоянстве условий для кормления зайцев их численность и численность волков неизменны во времени (зайцев как раз столько, что хватает для прокорма имеющихся волков), в системе существует равновесие. Пусть внешние условия изменятся так, что улучшится кормовая база зайцев. Их численность начнет возрастать, но тут же начнет возрастать и численность волков, и спустя некоторое время установится новое равновесие, при котором увеличение количества волков частично скомпенсирует указанное изменение внешних условий.
Дата добавления: 2020-10-25; просмотров: 496;











