Связывание субстрата карбоксипептидазой А
Связывание субстрата индуцирует большие структурные изменения активного центра карбоксипептидазы А. Представление о характере связывания субстратов с карбоксипептидазой А возникло на основе данных, полученных при изучении структуры комплекса этого фермента с глицилтирозином. Глицилтирозин – медленно гидролизуемый субстрат. Процесс его связывания (рис. 3.2.4 и 3.2.5) можно представить в виде пяти последовательных этапов.
1. Отрицательно заряженная концевая карбоксильная группа глицилтирозина вступает в электростатическое взаимодействие с положительно заряженной боковой цепью аргинина-145.
2. Субстрат через боковую цепь своего тирозина связывается в неполярном кармане фермента.
3. Водород NН-группы той пептидной связи, которая должна гидролизоваться, соединяется водородной связью с ОН-группой ароматической боковой цепи тирозина-248.
4. Карбонильный кислород той же пептидной связи вступает в координационную связь с ионом цинка.
5. Концевая аминогруппа субстрата образует водородную связь через вклинивающуюся молекулу воды с боковой цепью глутамата-270. Это взаимодействие, вероятно, не имеет места в случае реакционноспособного ЕS-комплекса, и именно оно, возможно, является причиной крайне медленного гидролиза глицилтирозина.
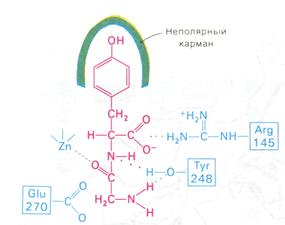
Рис. 3.2.4. Схематическое изображение связывания глицилтирозина в активном центре карбоксипептидазы А. Показан постулированный каталитически активный комплекс.
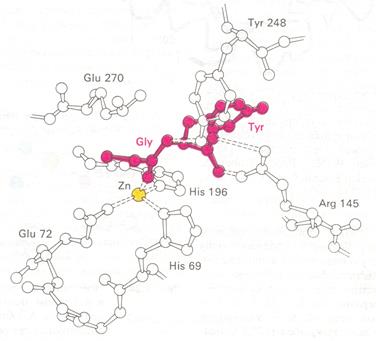
Рис. 3.2.5. Пространственное расположение глицилтирозина в активном центре карбоксипептидазы А. Глицилилтирозин (субстрат) изображен красным
Связывание глицилтирозина сопровождается структурной перестройкой активного центра (рис. 3.2.6). В сущности, только присоединив субстрат каталитические группы фермента принимают правильную ориентацию – положение, впервые постулированное Кошландом (Koshland) в его модели индуцированного соответствия. Гуанидиниевая группа аргинина-145, а также карбоксильная группа глутамата-270 перемещаются на 0,2 нм. Связывание карбонильной группы субстрата с ионом цинка вытесняет из связи с цинком молекулу воды. По крайней мере ещё четыре молекулы воды вытесняются из неполярного кармана на ферменте при связывании с ними тирозиновой боковой цепи в молекуле субстрата. Самое большое изменение конформации – это перемещение фенольного гидроксила тирозина-248 на 1,2 нм, то есть на расстояние, составляющее около 1/4 диаметра молекулы. Такое перемещение осуществляется в первую очередь, путем свободного вращения относительно одинарной связи -С-С- и состоит, что гидроксильная группа тирозина-248, бывшая на поверхности молекулы, перемещается, оказываясь вблизи пептидной связи субстрата. В результате закрывается полость активного центра и тем самым завершается превращение ее из области, заполненной водой, в гидрофобную. Все эти структурные изменения инициируются, по-видимому, связыванием аргинина-145 с концевой карбоксильной группой субстрата.
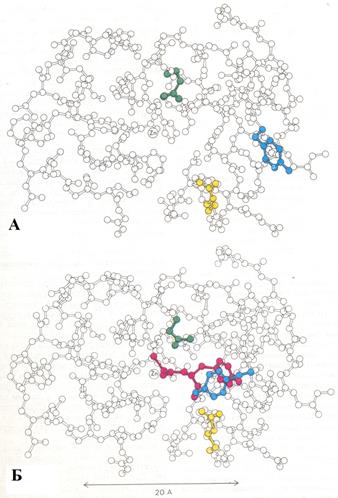
Рис. 3.2.6. Изменение структуры карбоксипептидазы А при связывании с субстратом
На рис. 3.2.12 буквой А обозначен фермент без субстрата (Arg 145 показан желтым, Glu 270 – зеленым, Tyr 248-синим); буквой Б – фермент-субстратный комплекс (глицилтирозин, субстрат, изображен красным). На рисунке показана только часть молекулы фермента
Дата добавления: 2020-10-01; просмотров: 565;











