По установлению молекулярного механизма действия КПА
На основе данных рентгеноструктурного анализа Липском (Lipscomb) предложил механизм каталитического действия карбоксипептидазы А. Постулированная структура реакционноспособного ЕS-комплекса показана на рис. 3.2.7.
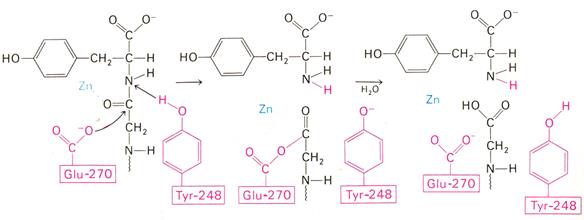
Рис. 3.2.7. Постулированный механизм каталитического действия карбоксипептидазы А: Glu-270 непосредственно атакует карбонильный углеродный атом гидролизуемой пептидной связи, а Туr-248 отдает протон на NН-группу этого пептида. Образующийся в результате ангидрид далее подвергается гидролизу
Согласно предложенному механизму, ОН-группа тирозина-248 отдаетпротон на NН-группу расщепляемой пептидной связи. Карбонильный атом углерода этой пептидной связи подвергается атаке со стороны карбоксильной группы глутамата-270, которая выступает в данном случае как нуклеофильная группа. Образующийся в результате ангидрид глутамата-270 и кислотного компонента субстрата подвергается далее гидролизу.
Возможен и другой механизм катализа, также согласующийся с данными рентгеноструктурного анализа; он показан на рис. 3.2.8.
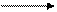
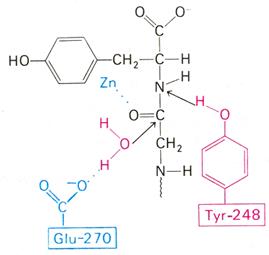
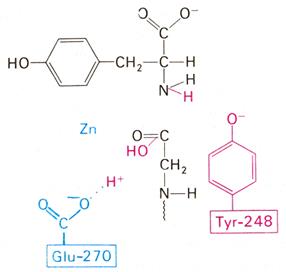
Рис. 3.2.8. Второй возможный механизм каталитического действия карбоксипептидазы А.
Туг 248 выполняет ту же функцию, что и на рис. 3.2.7. В остальном процесс протекает иначе: Glu 270 активирует молекулу воды, которая атакует карбонильный атом углерода расщепляемой пептидной связи. Гидролиз осушествляется прямо, без промежуточного образования ангидрида.
По этой схеме глутамат-270 активирует молекулу воды. Образующийся ОН¯ непосредственно атакует карбонильный атом углерода расщепляемой пептидной связи. Одновременно тирозин-248 отдает протон на ее NН-группу, и в итоге пептидная связь гидролизуется. Этот механизм катализа отличается от механизма, приведенного на рис. 3.2.7, тем, что предполагает гидролиз водой непосредственно пептидной связи субстрата, а не промежуточно образующегося ангидрида. Проведенные в последнее время химические и спектроскопические исследования свидетельствуют о том, что гидролиз пептидных субстратов осуществляется по прямому механизму, тогда как гидролиз эфиров протекает через промежуточное образование ангидрида с глутаматом-270.
Какова роль цинка в этих схемах катализа? Карбонильная группа расщепляемой пептидной связи обращена к иону цинка таким образом, что связь С=О оказывается более поляризованной, чем обычно; это делает карбонильный атом углерода более чувствительным к нуклеофильной атаке. Неполярное окружение иона цинка увеличивает его эффективный заряд и тем самым его способность индуцировать диполь. Сильной поляризации карбонильной группы способствует также близость отрицательного заряда глутамата-270. Следовательно, карбокиспептидаза А индуцирует такое смещение электронов на субстрате, которое повышает скорость катализа.
Теперь мы можем оценить значение индуцированных субстратом структурных изменений в активном центре карбоксипептидазы А. В результате связавшийся на ферменте субстрат оказывается со всех сторон окруженным каталитическими группами. Это обеспечивает возможность катализа по причинам, о которых говорилось выше. Совершенно очевидно, что только гибкость структуры фермента обеспечивает попадание субстрата в сферу действия системы каталитических групп (и выход продуктов реакции из этой системы). В целом гибкая структура фермента имеет преимущество перед жесткой в том отношении, что она обладает гораздо большим выбором возможных конформаций, пригодных для катализа и сохраняющихся в процессе отбора. Кроме того, индуцированное соответствие вносит вклад в повышение специфичности фермента. В самом деле, в случае карбоксипептидазы А субстрат должен иметь концевой карбоксилат-ион; фермент «проверяет» его наличие таким путем: если концевой карбоксилат-ион имеется, то он образует солевую связь с аргинином-145, а это вызывает перемещение тирозина-248 в каталитически активное положение; если же концевого карбоксилат-иона нет, то тирозин-248 остается на месте и фермент не проявляет активности. Другими словами, индукция соответствия может функционировать как динамический процесс узнавания.
Дата добавления: 2020-10-01; просмотров: 560;











