Ферментативного катализа
Существуют четыре основных фактора, определяющих способность ферментов ускорять химические реакции.
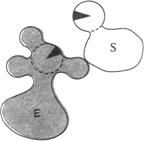
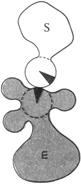
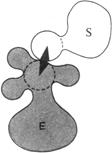
1.Сближение и ориентация. Фермент способен связывать молекулу субстрата таким образом, что атакуемая им связь оказывается не только расположенной в непосредственной близости от каталитической группы, но и правильно ориентированной по отношению к ней. В результате вероятность того, что комплекс ES достигнет переходного состояния, сильно увеличивается (рис. 3.1.3).
| а | б | в |
| 
| 
|
| Рис. 3.1.3. Процессы сближения и ориентации при взаимодействии молекулы субстрата S с каталитической группой в активном центре фермента Е: а – неправильная ориентация, неправильное сближение; б – правильное сближение, неправильная ориентация; в – правильное сближение, правильная ориентация |
2.Напряжение и деформация: индуцированное соответствие. Присоединение субстрата может вызывать конформационные изменения в молекуле фермента, которые приводят к напряжению структуры активного центра, а также несколько деформируют связанный субстрат, упрощая тем самым достижение комплексом ES переходного состояния.
При этом возникает так называемое индуцированное соответствиефермента субстрату (рис. 3.1.4).
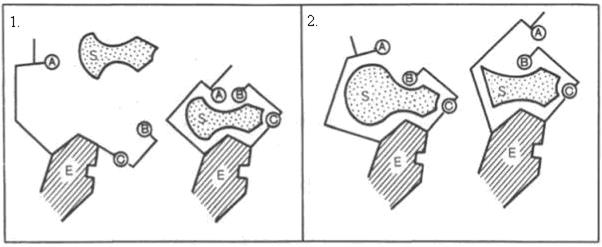
Рис. 3.1.4.Изменения структуры активного центра фермента, вызванные субстратом, согласно модели Д. Кошланда: 1 – активный комплекс; 2 – неактивный комплекс; А, В, С – функциональные группы активного центра
Таким образом, небольшие изменения третичной или четвертичной структуры относительно крупной молекулы фермента могут играть роль механического рычага для молекулы субстрата. Возможно, именно по этой причине ферменты представляют собой белки и, следовательно, по своим размерам значительно превосходят молекулы большинства субстратов.
3.Общий кuслотно-основный катализ. В активном центре фермента могут находиться группы специфических аминокислотных остатков, которые являются хорошими донорами или акцепторами протонов (рис. 3.1.5.). Такие кислотные или основные группы общего типа представляют собой мощные катализаторы многих органических реакций, протекающих в водных системах.
а
- СООН
- +NH3
- SH
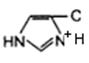
| б
- СОО-
- NH2
- S-
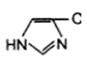
|
Рис. 3.1.5. Функциональные группы аминокислотных остатков, принимающие участие в каталитических процессах: а – протон-донорные группы; б – протон-акцепторные группы
4.Ковалентный катализ. Некоторые ферменты реагируют со своими субстратами, образуя очень нестабильные, ковалентно связанные фермент-субстратные комплексы, из которых в ходе последующей реакции образуются продукты реакции, причем значительно быстрее, чем в случае некатализируемых реакций:
| Некатализируемая реакция | RX + H2O → ROH + HX |
| Катализируемая реакция | RX + E-OH → ROH + EX EX + H2O → E-OH + HX |
| Суммарная реакция | RX + H2O → ROH +HX |
В некоторых ферментативных реакциях фермент замещает функциональную группу R в субстрате RX, в результате чего образуется ковалентный комплекс ЕХ. Он нестабилен и гидролизуется значительно быстрее, чем RX. К ферментам, осуществляющим ковалентный катализ, отноcится химотрипсин.
Перечисленные выше факторы, по-видимому, в различной степени ускоряют химические реакции. Однако для многих ферментов пока не известно точного механизма, обеспечивающего ускорение той или иной специфической реакции.
Дата добавления: 2020-10-01; просмотров: 599;











