Уровни структурной организации ферментов в клетке
В клетке есть ферменты разной структурной организации – от простых мономерных до ферментов, объединенных в ферментные ансамбли. Ферменты по их структурной организации можно разделить на:
1. Мономерные ферменты;
2. Олигомерные ферменты (простые, построенные из субъединиц одного типа);
3. Олигомерные ферменты (сложные, построенные из субъединиц разного типа);
4. Ферментные комплексы : а) мультиферментные комплексы,
б) мультиферментные конъюгаты;
5. Ферментные ансамбли: а) адсорбционные,
б) интегральные.
Значения молекулярных масс ферментов колеблются в широких пределах: от нескольких тысяч до нескольких миллионов. В природе насчитывается несколько десятков ферментов, обладающих сравнительно небольшими молекулами (до 50 кДа). Большинство же ферментов представлено белками более высокой молекулярной массы, построенными из субъединиц (рис.4.1.3).
|
|
|
|
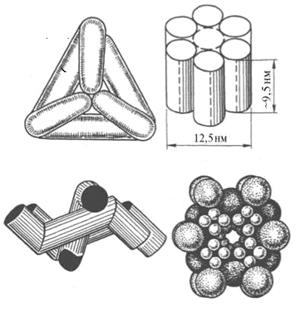
Рис. 4.1.3. Модели строения некоторых олигомерных ферментов: а ‒ молекула глутаматдегидрогеназы, состоящая из 6 протомеров; б ‒ молекула РНК-полимеразы; в ‒ половина молекулы каталазы; г ‒ молекулярный комплекс пируватдегидрогеназы.
Так, каталаза (252 кДа) содержит в молекуле шесть протомеров с молекулярной массой 42 кДа каждый. Молекула фермента, ускоряющего реакцию синтеза рибонуклеиновых кислот (РНК-полимераза, 400 кДа), состоит из 6 неравных субъединиц. Полная молекула глутаматдегидрогеназы, ускоряющей процесс окисления глутаминовой кислоты (336 кДа), построена из 6 субъединиц с молекулярной массой 56 кДа.
Процесс олигомеризации придает субъединицам белков повышенную стабильность. Связи в комплексе в основном нековалентные, поэтому такие ферменты легко диссоциируют на протомеры.
Способы компоновки протомеров в мультимеры разнообразны. Крайне важно, что достроенный из субъединиц фермент проявляет максимальную каталитическую активность именно в виде мультимера: диссоциация на протомеры резко снижает активность фермента. Не все ферменты-мультимеры построены исключительно из каталитически активных протомеров. Наряду с каталитическими в их составе отмечены регуляторные субъединицы, как, например, у аспартат-карбамоилтрансферазы.
Среди ферментов-мультимеров безусловно преобладают димеры и тетрамеры (их несколько сотен), в меньшей мере распространены гексамеры и октамеры (несколько десятков) и необыкновенно редко встречаются тримеры и пентамеры.
Молекулы ферментов-мультимеров в ряде случаев составлены из субъединиц двух типов, обозначаемых условно как субъединицы типа А и В. Они сходны друг с другом, но отличаются по некоторым деталям первичной и третичной структур. В зависимости от соотношения протомеров типа А и В в мультимере последний может существовать в виде нескольких изомеров, которые называют изозимами. Так, при четырех субъединицах возможны 5 изозимов:
I II III IV V
AAAA AAAB AABB ABBB BBBB
В настоящее время интерес к изозимам резко повысился. Оказалось, что кроме генетически детерминированных изозимов существует большая группа ферментов, обладающая множественными формами, возникающими в результате их посттрансляционной модификации. Множественные формы ферментов и изозимы в частности используются сейчас для диагностики болезней в медицине, прогнозирования продуктивности животных подбора родительских пар при скрещивании для обеспечения максимального гетерозиса в потомстве и т. п. (более детально эти вопросы рассмотрены в лекции 5.2).
Дата добавления: 2020-10-01; просмотров: 799;











