Лекция 2.3. Ингибиторы ферментов.
На активность ферментов оказывают влияние множество факторов, среди которых важную роль играют ингибиторы, воздействие которых снижает активность ферментов.
Различают обратимое и необратимое ингибирование. Необратимый ингибитор или каталитический яд, взаимодействуя с ферментом, снижает его активность до нуля (отравляет фермент). Поэтому они не представляют особого интереса для ферментативной кинетики.
Яркий пример необратимого ингибирования – ингибирование ацетилхолинэстеразы фторорганическими соединениями (рис. 2.3.1.). Ацетилхолинэстераза катализирует гидролиз ацетилхолина, избыток которого может полностью блокировать передачу нервного импульса через синапс. Поэтому фторорганические соединения являются сильными ядами.
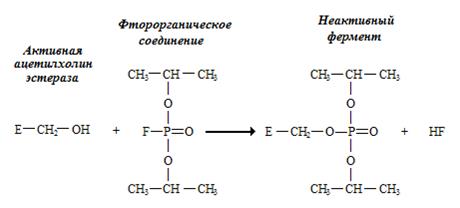
Рис. 2.3.1. Необратимое ингибирование ацетилхолинэстеразы
Другой пример – действие аспирина на циклооксигеназы. Ацетилсалициловая кислота ацилирует фермент в активном центре по остатку серина (рис. 2.3.2.).
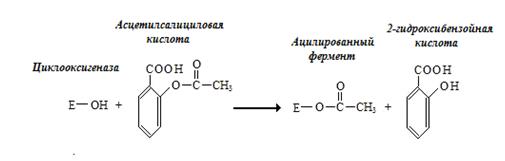
Рис. 2.3.2. Необратимое ингибирование циклооксигеназы
Необратимым ингибитором для ферментов, содержащих SH-группу цистеина в активном центре, является иодуксусная кислота и иодацетамид (рис. 2.3.3.).
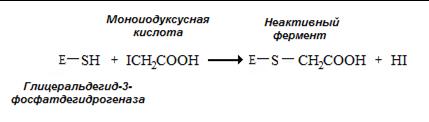
Рис. 2.3.3. Необратимое ингибирование глицеральдегид-3-фосфатдегидрогеназы
Исследование кинетики необратимого взаимодействия конкурентных ингибиторов с ферментами может быть использовано для определения абсолютной концентрации ферментов или, в случае, когда молекула фермента содержит несколько активных центров, для определения абсолютной концентрации активных центров. Обязательные требования к ингибиторам, с помощью которых такие определения могут быть проведены даже для неочищенных ферментных препаратов: а) необратимость взаимодействия; б) специфичность реакций с активными центрами исследуемого фермента (т.е. отсутствие взаимодействия с другими веществами); в) строгая стехиометрия взаимодействия с активными центрами фермента.
Отвечающие этим требованиям ингибиторы могут быть использованы для определения молекулярной активности ферментов путём прямого «титрования» активных центов, либо для определения их абсолютной концентрации кинетическим методом.
«Титрование» активных центров. Если ингибитор I реагирует с активными центрами Е фермента стехиометрически по уравнению
Е+I→ EI,
то зависимость между концентрацией ингибитора и степенью конечного торможения скорости ферментативной реакции будет выражаться прямой линией. Это объясняет тем, что скорость реакции при прочих равных условиях пропорциональна концентрации фермента, а последняя будет линейно изменяться с изменением концентрации ингибитора, стехиометрически реагирующего с активными центрами. Легко видеть, что тангенс угла наклона такой прямой в координатах v – [I] даёт прямо величину молекулярной активности vm фермента, т.е.
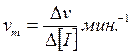
Для иллюстрации этого метода на рис.2.3.4 показана зависимость между концентрацией конкурентного высоко специфичного необратимого ингибитора и конечными величинами остаточной активности ацетилхолинэстеразы нервной ткани мух. В качестве ингибитора в этом случае был применён метилсульфометилат О-этил-S-β-меркаптоэтилтиоэтилового эфира метилфосфиновой кислоты, имеющий в растворе ионное строение
 C2H5O O
C2H5O O
CH3
Как видно на рис. 2.3.4, линейный характер зависимости наблюдается в широких пределах степени торможения ферментативной реакции. Вычисленное по наклону прямой значение молекулярной активности ацетилхолинэстеразы нервной ткани мух составляет 81000 мин-1.
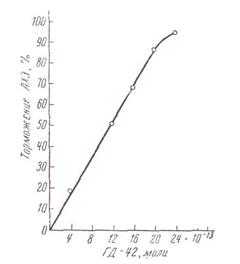

Рис. 2.3.4. Зависимость степени торможения активности ацетилхолинэстеразы головного мозга мясных мух от концентрации ингибитора - метилсульфометилата О-этил-S-β-меркаптоэтилтиоэтилового эфира метилфосфиновой кислоты
Зная молекулярную активность 𝑣m и определив при тех же условиях (в отсутствие ингибитора) скорость ферментативной реакции 𝑣 в присутствии неизвестного количества фермента, можно рассчитать концентрацию фермента [Е] по соотношению:
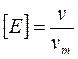
Кинетический метод определения концентрации ферментов. Метод основан на следующих кинетических соотношениях. Константа скорости бимолекулярной необратимой реакции фермента с ингибитором при эквимолекулярных соотношениях реагирующих веществ определяется уравнением
k(i)t = 1/[E]t – 1/[E]о, (1)
где [E]t – текущая концентрация фермента; [E]о – начальная концентрация фермента; t – время взаимодействия фермента с ингибитором.
Из уравнения (1) следует, что при эквимолекулярных концентрациях фермента и ингибитора между величиной, обратной текущей концентрации фермента, и временем реакции с ингибитором должна быть линейная зависимость. Но так как
[E] = v/vm,
то при эквимолекулярных концентрациях фермента и ингибитора соблюдается зависимость
k(i)t = vm/vt – vm/vo = vm(1/vt – 1/vo).
Таким образом, варьируя начальную концентрацию ингибитора при постоянной концентрации фермента и субстрата, можно опытным путем найти такие соотношения, когда зависимость 1/vt от t будет линейной. Овевидно, что при найденных соотношениях концентрация фермента (активных центров) будет равна концентрации ингибитора.
На рис. 2.3.5представлены результаты исследования кинетики ингибирования холинэстеразы армином при его различных концентрациях, выраженные в форме зависимости 1/vt от t.
Прямолинейный характер этой зависимости для данной концентрации фермента выявляется при концентрации армина 0,57х10-7М. Рассчитанная по этим результатам молекулярная активность холинэстеразы сыворотки крови лошади составляет ≈ 70000 мин-1, что хорошо совпадает со значением, полученным другими методами.
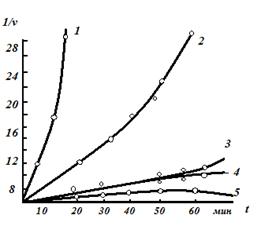
Рис.2.3.5. Кинетика ингибирования холинэстеразы сыворотки
крови лошади армином при различных его концентрациях: 1 – 2.5х10-7М; 2 – 1х10-7М; 3 – 0.6х10-7М; 4 – 0.; 5 – 0.4 х 10-7М
Результаты определения vm могут быть использованы для расчета молярной концентрации фермента (активных центров) и, следовательно, использованы для вычисления кинетических констант.
Гораздо больший интерес представляют обратимые ингибиторы. Они образуют с ферментом динамический комплекс, отличающийся по своим кинетическим свойствам от свободного фермента.
Характерная черта обратимого ингибирования – наличие равновесия между ферментом и ингибитором. При этом константа равновесия или константа ингибирования (Кi) служит мерой сродства фермента и ингибитора и выражает эффективность действия ингибитора.
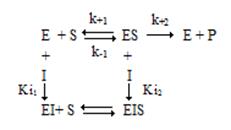
Можно выделить четыре типа обратимого ингибирования: конкурентное, неконкурентное, бесконкурентное и ингибирование смешанного типа.
Общая схема ингибирования:
Дата добавления: 2020-10-01; просмотров: 703;











