Роль металлов в функционировании ферментов
Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Роль металлов в ферментативном катализе разнообразна.
Во-первых, металл может способствовать образованию промежуточного соединения между ферментом и субстратом. Именно такой случай наблюдается при действии лейцинаминопептидазы и карбоксипептидазы А – присоединение фермента к субстрату осуществляется, благодаря образованию координационных связей через атом марганца (или магния) и атом цинка (рис. 1.4.24).
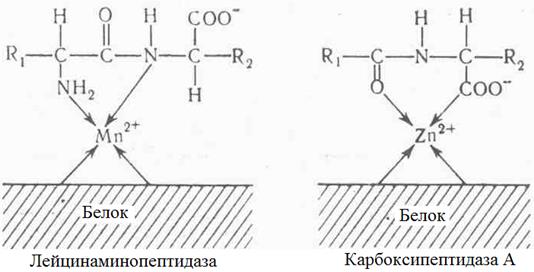
Рис. 1.4.24. Роль металла в присоединении субстрата к ферменту
Во-вторых, металл может сам участвовать в реакции, например в переносе электронов, то есть в окислительно-восстановительных реакциях. Это происходит при действии нитратредуктазы. Входящий в состав данного фермента молибден сам взаимодействует с нитратом и затем с флавиновым ферментом, который, в свою очередь, реагирует с содержащей NАD+ или NАDР+ дегидрогеназой. Это ясно из рис. 1.4.25.

Рис. 1.4.25. Участие молибдена в действии нитратредуктазы
В-третьих, металл может обеспечивать сохранение вторичной, третичной и четвертичной структуры ферментного белка. В этом отношении прекрасным примером является α-амилаза. Все виды α-амилазы – панкреатическая, солодовая, плесневая, бактериальная и слюнная – содержат кальций, который необходим именно для поддержания вторичной и третичной структуры фермента.
Лишённая кальция α-амилаза имеет такую же активность, как и нативный, содержащий кальций фермент. Это ясно видно из рис. 1.4.26. Этот же рисунок показывает, что фермент, лишенный кальция, крайне неустойчив, чрезвычайно легко денатурируется и теряет активность в результате двухчасовой инкубации при рН, отклоняющемся от оптимального.
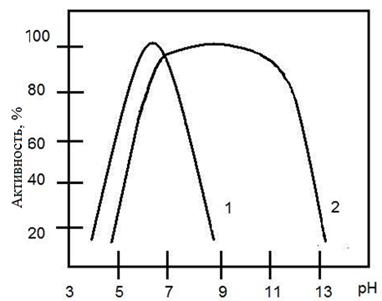
Рис. 1.4.26. Стабильность α-амилазы Bacillиs sиbtilis при инкубации в течение двух часов при 25º и разных рН (по Э. Фишеру и сотр.). 1 – без Cа2+; 2 – с Са2+
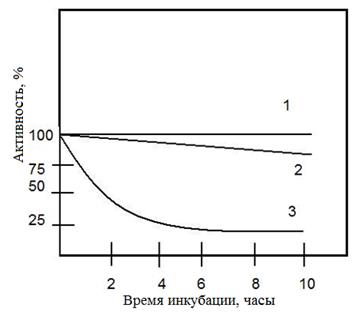
Рис. 1.4.27. Влияние ЭДТА и трипсина на α-амилазу Bacillиs sиbtilis (по Э. Фишеру). 1 – инкубация с трипсином; 2 – инкубация с ЭДТА; 3 – инкубация с ЭДТА и трипсином (рН 7,5; 25º)
Таким образом, при оптимальном рН вторичная и третичная структура фермента поддерживается благодаря водородным и другим дополнительным связям; при более кислой и более щелочной реакции среды на первый план в качестве фактора, стабилизирующего структуру фермента, выступает кальций.
Стабилизация структуры фермента под влиянием кальция проявляется также в том, что фермент, лишенный кальция, очень легко расщепляется протеолитическими ферментами. Это видно на рис. 1.4.27, показывающем активность α-амилазы, обработанной трипсином и ЭДТА, который связывает кальций, образуя е ним прочнoe внутрикомплексное соединение (хелат). Из рисунка также видно, что трипсин практически не расщепляет α-амилазу; однако если α-амилаза предварительно обработана ЭДТА,то она быстро расщепляется трипсином. Таким образом, кальций в данном случае играет роль фактора, предохраняющего α-амилазу от расщепления протеолитическими ферментами.
Что касается роли металла в поддержании четвертичной структуры ферментного белка, то в этом отношении хорошим примером является дрожжевая алкоголь дегидрогеназа. Этот фермент имеет молекулярную массу 151 кДа, содержит четыре атома цинка в молекуле и четыре молекулы NАD+. Удаление цинка из молекулы алкогольдегидрогеназы вызывает не только её инактивацию, но и диссоциацию ферментного белка на четыре неактивные субъединицы с молекулярной массой 36 кДа каждая.
Наконец, четвертый возможный способ действия металла – когда металл способствует соединению апофермента с коферментом. Подобное действие металла наблюдается в случае алкогольдегидрогеназы и глицеральдегидфосфатдегидрогеназы.
Заканчивая раздел, посвященный роли металлов в ферментативном катализе, нужно подчеркнуть, что за последние годы все чаще выявляется, что тот или иной металл в незначительных количествах играет важную роль в ферментативных реакциях. Роль так называемых микроэлементов в обмене веществ растений и животных как раз и заключается в том, что они необходимы для построения и нормального функционирования целого ряда ферментов.
Все это еще раз свидетельствует о том, что различные стороны обмена веществ неразрывно связаны между собой – недостаток или нарушение обмена какого-либо металла в растительном или животном организме сразу же сказывается на действии того или иного фермента, вызывая соответствующее заболевание
ЛЕКЦИЯ 1.5.
Дата добавления: 2020-10-01; просмотров: 852;











