И сложных ферментов
Любая ферментативная реакция начинается с взаимодействия субстрата, в большинстве случаев, небольшой по размерам молекулы, с активным центром фермента. Под активным центром фермента понимают совокупность аминокислотных остатков, осуществляющих связывание (сорбцию) субстрата, его химическую активацию и превращение. Активный центр белковой молекулы фермента имеет сложную конфигурацию; он включает как полярные (гидрофильные), так и неполярные (гидрофобные) группы.
Структура активного центра фермента складывается из двух составляющих:
1) сорбционного участка (подцентра, сайта), ответственного за связывание, фиксацию и ориентацию субстратов; свойства этого центра определяют специфичность действия фермента;
2) каталитического участка (подцентра, сайта), осуществляющего химическое превращение молекул субстрата и использующего для этих целей, как правило, общий кислотно-основной катализ.
Аминокислотные остатки, образующие каталитический центр однокомпонентного фермента, расположены в различных точках единой полипептидной цепи. Поэтому активный центр, представляющий собой уникальное сочетание нескольких аминокислотных остатков, возникает в тот момент, когда белковая молекула приобретает присущую ей третичную структуру. Чаще всего в активных центрах однокомпонентных ферментов встречаются остатки Ser, His, три, Arg, Cys, Asp, Glu и Tyr. Изменение третичной структуры фермента под влиянием тех или иных факторов может привести к деформации активного центра и изменению ферментативной активности.
Активный центр двухкомпонентных ферментов представлен небелковым компонентом – коферментом (простетической группой) и несколькими выше приведенными минокислотными остатками.
Характерной особенностью cложных или двухкомпонентных ферментов является то, что ни белковая часть, ни добавочная группа в отдельности не обладают заметной каталитической активностью. Только их комплекс проявляет ферментативные свойства. При этом белок резко повышает каталитическую активность добавочной группы, присущую ей в свободном состоянии в очень малой степени; добавочная же группа стабилизирует белковую часть и делает ее менее уязвимой к денатурирующим агентам. Таким образом, хотя непосредственным исполнителем каталитической функции является простетическая группа, образующая каталитический центр, ее действие немыслимо без участия полипептидных фрагментов белковой части фермента.
В апоферменте есть участок, характеризующийся специфической структурой, избирательно связывающий кофермент. Это так называемый кофермент связывающий домен; его структура у различных апоферментов, соединяющихся с одним и тем же коферментом, очень сходна. Таковы, например, пространственные структуры нуклеотидсвязывающих доменов ряда дегидрогеназ (рис. 1.5.1).
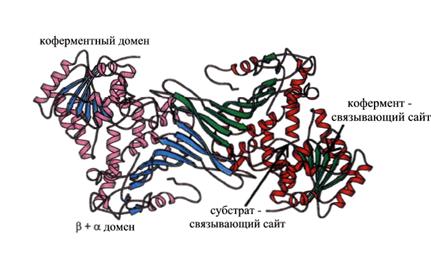
Рис. 1.5.1. Активный центр глюкозо-6-фосфатдегидрогеназы
Дата добавления: 2020-10-01; просмотров: 664;











