КЛАСТЕРЫ И УЛЬТРАДИСПЕРСНЫЕ ЧАСТИЦЫ
«Безлигандные» кластеры
Термин «кластер» происходит от английского слова cluster, означающего рой, гроздь, скопление. Введен в научный обиход американским физико-химиком Ф.Коттоном и в первоначальном своем смысле обозначал полиядерные металлорганические соединения, содержащие не менее трех атомов металла, расстояния между которыми допускают прямое валентное (химическое) взаимодействие, т.е. являются заметно меньшими суммы ковалентных радиусов и меньшими, чем в компактных металлах. С точки зрения этого определения понятия «кластер» моно- или биядерные частицы кластерами не являются, хотя из них последние и строятся.
В дальнейшем по мере проникновения этого термина в научную среду и, исходя из общего его смысла, слово «кластер» стало использоваться практически во всех разделах современного знания от естественных наук (например, в астрономии им обозначают скопление звезд и галактик) до гуманитарных (в социологии «кластером» обозначают социально однородную группу людей).
В современной химии понятие «кластер» обычно относят к трем видам объектов, связанных друг с другом взаимными превращениями (рис.). Это: 1- ультрадисперсные металлические порошки с размером частиц меньше 300 Å, т.е. имеющими размер, ставящих их в разряд наночастиц, и безлигандные кластеры; 2- молекулярные или ионные соединения металлов, стабилизированные органическими или неорганическими лигандами; 3- кластерные материалы. Несколько особняком в этой классификации располагается большая группа соединений, называемых обменными кластерами, в которых связь между атомами металла осуществляется через обменные взаимодействия различных типов, например через мостиковые лиганды. Однако помимо «обычного» использования это понятие сейчас уже не менее широко используется и для совершенно иных объектов химии, в том числе и не содержащих металлы и связанных не валентными взаимодействиями, например кластеры «воды», «бензола» и т.п., т.е. то, что еще совсем недавно обозначалось как «димеры», «тримеры», «ассоциаты» и т.д. При этом полностью игнорируется тот факт, что рассматриваемые «кластеры» являются не вполне устойчивыми образованиями. Но совсем недопустимы пассажи типа «Под кластерами понимают группу атомов или молекул, объединенных физическим взаимодействием в единый ансамбль, но сохраняющих внутри него индивидуальное поведение. Возможности прямого наблюдения кластеров ограничены, и поэтому экспериментаторы компенсируют аппаратурные недостатки интуицией и теоретическими построениями» (В.Белянин, Е. Романова, Наука и жизнь, 2004, №10). В этой цитате почти все неверно, начиная с того, что авторы понимают под физическим взаимодействием, и кончая трудностями изучения кластеров. Если под физическим взаимодействием понимается любой из известных типов вандерваальсова взаимодействия, то мы уже рассматривали с вами подобные объекты и отнесли их в раздел супрамолекулярной химии. Естественно, что в этом разделе могут быть размещены и кластеры в их понимании Коттоном.
Ультрадисперсное состояние вещества и металлов в частности, имеющих размер частиц менее 300 Å (<30 нм), занимает особое положение между индивидуально молекулой или атомом, с одной стороны, и веществом в компактном («обычном») состоянии, с другой. Его отличительными особенностями являются: 1-доля поверхностных атомов соизмерима с числом атомов внутренних; 2- соизмеримы и их энергии; 3-структура частицы отличается от структуры массивного вещества, например металла, часто отсутствует плотная упаковка, изменены расстояния и т.п.; 4- форма и структура носят ярко выраженный неравновесный характер, которые отвечают энергонасыщенным состояниям. Последнее обстоятельство может проявляться в значительном снижении т. пл., в выделении энергии в процессе хранения, причем в количествах достаточных для самопроизвольного спекания частиц или для их взаимодействия с матрицей, в которой они диспергированы, и т.д. При этом для УДЧ изменяются многие физико-химические и физические характеристики, такие как твердость, которая может достигать теоретических значений, увеличение вязкости и предела текучести, проводимость, магнитные свойства и т.д. Естественно, что все эти состояния неравновесны. В одних случаях это метастабильное состояние, в других кинетически заторможенное. Однако время релаксации для них сравнительно велико, локальное равновесие успевает установиться и, в ряде случаев, при описании таких систем применим термодинамический подход, но в более сложном варианте, поскольку требует учета дисперсности частицы, т.е. введения дополнительной координаты в обычно используемом в физико-химическом методе анализа описании «состав-свойство». Действительно, уже имеются работы, в которых показано, что алмаз в ультрадисперсном состоянии (до 40 Å) термодинамически более стабилен, чем графит такого же размера, и последний переходит в первый при довольно умеренных температурах и даже в вакууме. Хорошо известны исследования по синтезу поликристаллических алмазных пленок путем пиролиза ацетилен-водородных пламен при 800-900 0С и давлении меньше атмосферного, что существенно отличается от условий классического фазового перехода «графит-алмаз» в компактном материале. Совсем недавно в 2004 г. опубликована работа, согласно которой алмаз можно получить простым нагреванием изомера полиацетилена (СН)n с sp3-гибридизованными атомами углерода и синтезированного дебромированием бромоформа Na/K сплавом или вообще при взаимодействии двуокиси углерода или карбонатов с парами натрия при 600-700 0С. Неудивительно, что появились работы, в которых делается попытка пересмотра расчетов Лейпунского и на основании которых построена фазовая диаграмма углерода с одной стабильной фазой – графитом. Однако вряд ли это удастся сделать, поскольку имеется достаточно много убедительных доказательств метастабильности алмаза и последнее по времени из этих доказательств связано с изучением фазового перехода «графит-алмаз» in situ под давлением до 17 ГПа при комнатной температуре. В этой работе убедительно показано, что при снятии давления прозрачная алмазоподобная фаза, образующаяся из графита только за счет воздействия очень высокого давления, вновь достаточно быстро и на 100 % переходит в исходное состояние, т.е. в графит.
Из других примеров: обнаружен переход «металл«диэлектрик», возникающий с изменением размера частицы металла. Так, температура плавления золота в УД состоянии на 300-500 Со ниже, чем в компактном состоянии. Более того, в наносостоянии золото реагирует с СО2, давая окись и аморфный углерод!
На рис. 53 приводится зависимость изменения температуры плавления алюминия от размера частиц, а на рис. 54 зависимость доли поверхностных атомов алюминия от их
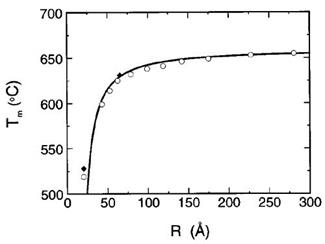
Рис. 53. Зависимость температуры плавления наночастиц алюминия Tm от их радиуса.
общего количества в некой произвольной единице объема.
В кубике из алюминия с ребром 1 см число поверхностных атомов будет равно 36.1014, а число внутренних атомов - 6.1022. Отсюда доля поверхностных атомов будет составлять 6.10-8. Если сделать такие же вычисления для кубика из алюминия размером 5 нм, то на его поверхности окажется уже 12% всех его атомов, а на поверхности кубика
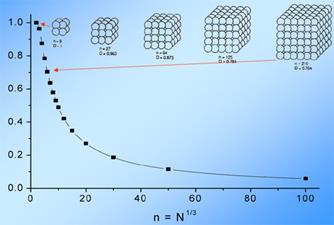
Рис. 54. Зависимость «поверхностной» доли атомов (ось ординат) от кубического корня из их числа N в кубике кристаллического вещества.
размером 1 нм, вообще, больше половины всех атомов.
Появившееся в последнее время большое количество работ по нанокластерам углерода, начиная с фуллерена и кончая графеном, не перестают удивлять. Из последних достижений можно отметить определение теплопроводности графенового листа (рис. 55), которая оказалась равной 5300 Вт/м∙К против 3500 Вт/м∙К для одностенных нанотрубок и 2200 Вт/м∙К для алмаза, который еще совсем недавно считался чемпионом по этому показателю. Из подобных фактов, а их уже имеется достаточно много, можно сделать вывод, что размер частицы является активной переменной, определяющей вместе с другими термодинамическими функциями состояние системы, ее реакционную способность и даже физическую сущность. Условно размер частицы при проведении твердофазной реакции можно приравнять к эквиваленту температуры, и отсюда предположить
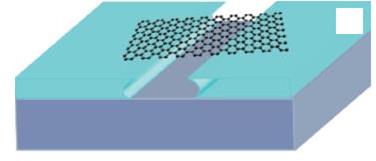
Рис. 55. Схематическое изображение подготовленного для эксперимента листа графена на подложке из кремния
возможность протекания для наночастиц реакций, которые в этих условиях никогда не наблюдаются для компактного вещества. Так, например, алюминий, диспергированный с применением методов механохимии в присутствии графита, реагирует с ним с образованием Al4C3 не при 1500 Со, а при 500-600 Со. В общем же размерные явления в химии выражаются в качественном изменении химических свойств и реакционной способности в зависимости от количества атомов или молекул в частице вещества и эта эволюция свойств, изучение мостов между единичной молекулой, атомом и макроскопическим миром вещества наиболее интересная составляющая в фундаментальных исследованиях наносостояния материи. Существуют экспериментальные попытки связать число атомов в частице, формы или способа ее организации с изменением химических и физических свойств и даже создать некое подобие Периодической таблицы, хотя для подобного обобщения явно не хватает материала и поэтому предлагаемые в литературе подходы следует признать преждевременными.
Из вышеприведенных рассуждений и примеров следует, что рассматривать наночастицы и производную от них - нанохимию как химию просто мелких частиц пусть даже, если их размер находится в нанодиапазоне, принципиально неверно, ибо помимо размера эти частицы должны обладать неким комплексом свойств, отличающим их от компактного или массивного вещества, материала, металла. Иными словами, подобное состояние вещества следует отнести к особому промежуточному состоянию - состоянию между отдельными атомами и твердым веществом с оригинальным набором свойств, отличающим его от последних двух. В соответствии с этим для этого состояния выработаны самостоятельные дефиниции.
Обычно к наночастицам относят гомо- или гетероатомные объекты с размером 1-10 нм, хотя в некоторых случаях они могут иметь и больший размер, но при этом должны обязательно проявлять свойства отличные от компактного вещества и молекулярных кластеров. Отсюда следует, что понятие УДЧ более широкое, поскольку включает частицы с размером от нескольких до сотен ангстрем. Наноструктура – совокупность наночастиц определенного размера, связанных друг с другом химическими или физическими силами. Нанокомпозиты – сложные объекты, состоящие из наночастиц и связующего, или двух и более типов наночастиц, или из них и связующего, но во всех случаях межчастичные взаимодействия в них становятся настолько сильными, что маскируют свойства изолированных частиц, т.е. весь объект приобретает новые свойства не типичные для составляющих его компонентов или фаз. При этом следует иметь ввиду, что и понятие фаза для веществ подобного размера выражено менее однозначно, поскольку граница между гомогенной и гетерогенной фазами становится размытой и определить ее строго количественными критериями невозможно. Более того, следует признать, что попытки проведения работ в этом направлении просто бесперспективны по всем параметрам. На сегодняшний день эта нижняя граница (верхняя – это один атом или одна молекула) скорее определяется здравым смыслом экспериментатора, чем некими строго сформулированными законами. Этот смысл базируется на двух понятиях наночастица и нанореактор. В чем их различие? Первое характеризует размерный параметр наночастицы, второе ее функциональную особенность или просто функцию.
Простейшие нанореакторы с пространственно организованными реагентами, находящиеся на верхней границе размеров – ван-дер-ваальсовы молекулы, т.е. образования слабосвязанных ионов, атомов, радикалов, молекул. В настоящее время известно огромное число таких молекул, например He·NH3, C2H4·Ar, Ar·I2, Al·N2 и др., которые являются надежным источником для определения атом-атомных потенциалов, ответственных за молекулярную организацию кристаллов, саморепликацию биомолекул и самоорганизацию супрамолекулярных ансамблей и определяющих макросвойства газов, фазовые переходы и многое другое. Более сложные образования, но также относящиеся к нанореакторам – это ансамбли из гостевых молекул, атомов, ионов, расположенных в полостях различной природы от “грубых” и малочувствительных к изменяющимся условиям молекул краун- эфиров до каликсаренов, карсеплексов или циклодекстринов, способных избирательно захватывать молекулы гостей и выпускать их на свободу при замене растворителя или изменении рН, совершенно необычные 1D-0D образования под названием пиподы – нанотрубки, заполненные молекулами фуллеренов от С36 до С82 или экзофуллеридов типа Ln@C82, которые могут давать внутри трубки одномерную полимерную цепочку или быть продопированы (в случае фуллеритов) атомами щелочных металлов. В этих удивительных образованиях гостевые молекулы не просто занимают некое геометрическое пространство, но ведут себя довольно «нахально» - крутятся, катаются, сталкиваются.
Цеолитовые пещеры и межслоевые пространства в графите, халькогенидах, глинах, и искусственно созданных двумерных графитоподобных нанореакторов на основе оксофосфатов с изменяемой геометрией межслоевого пространства за счет изменяемой длины гибкоцепных полиметиленовых мостиков, соединяющих слои, и их числа (рис. 56),
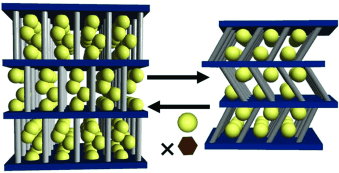
Рис. 56. Схема изменения геометрии межслоевого пространства и количества гостей в гибкоцепных слоевых структурах.
кристаллосольваты и клатраты, молекулы фуллерена с дефицитом 2 атомов на поверхности, что открывает доступ молекул-гостей внутрь сферы, и тому подобные еще совсем недавно немыслимые комбинации веществ - все это нанореакторы или наноконтейнеры, в которых происходят реакции невообразимые в макросостоянии, зачастую «навязанные» необычной геометрией ансамбля, изменениями в энергиях активации, механизмах и прочими аномалиями, связанными с наносостоянием взаимодействующих компонентов.
В случае, когда размер определяет функцию, понятия наночастица и нанореактор совпадают. Так, имеются данные, что кластер, содержащий ≤15 атомов железа, обладает обоими свойствами, а при большем числе он остается нанокластером, но теряет свойства нанореактора, т.е. по своим свойствам как бы приближается к металлическому железу. В ансамбле, образованном α-нафтолом и водой первый проявляет себя в обеих ипостасях только при n(Н2О)<20. При больших значениях n химические аномалии исчезают, α-нафтол диссоциирует по кислотному типу и протон присоединяется к воде. Следует все же отметить, что приведенные литературные примеры весьма эффектны и ими можно оперировать, но трудно согласиться. Хотя бы потому, что в кластере из 15 атомов железа только 2 или 3 атома являются внутренними, вся конструкция неравновесна и весьма затруднительно представить, о каком макрометаллическом состоянии здесь можно говорить. Об этой неопределенности говорят и найденные зависимости реакционной способности нанокомпонентов от числа атомов в них. Так, ион одновалентного магния Mg+ реагирует с водой с выделением водорода по реакции Mg+(H2O)n →(MgOH)+(H2O)n-1 + H только при 6≤n≤15. Означает ли это, что при n≤6 кластер воды приобретает макросвойства, в интервале значений 6-15 он становится нонореактором, а потом опять обычной водой? Вряд ли, тем более, что подобные нелинейные зависимости свойств кластеров от числа атомов далеко не единичны и скорее всего характеризуют лишь отношение к данному свойству, в случае кластеров воды - отношение к иону магния+1.
Высокая реакционная способность и микронеравновесность УДЧ делают совершенно неприемлемыми для их получения классические методы измельчения вещества, основанные на механическом диспергировании. К настоящему времени разработано несколько способов получения УДЧ, позволяющих реализовать сильно неравновесное состояние: 1-путем деформации, например при использования давления со сдвигом; 2- облучением твердого тела нейтронами или потоками заряженных частиц; 3- переохлаждением расплавов или наоборот – нагревом с последующей ударной закалкой; 4- разложением молекулярных кластеров, МОС, карбонилов, гидридов и других нестабильных веществ; 5- химическое восстановление солей металлов водородом или комплексными гидридами в растворителях различной природы; 6- фотовосстановление или восстановление жестким γ-излучением.
Наиболее удобный способ, который одновременно является и наиболее общим при получении УДЧ, основан на конденсации паров металла, получаемых самыми разнообразными методами. Непременным условием для их реализации должна являться только высокая скорость нуклеации, при минимальных скоростях агрегации атомов, приводящей к росту частиц. К этим методам относятся методы плазмохимического, термического, лазерного и т.п. испарения металлов, метод взрыва проводника при пропускании через него тока большой мощности. (Последний метод в исполнении «великих» московских физиков с благословения Московского правительства предлагается «использовать» для трансмутации элементов. Видимо бюрократов прельстила разрекламированная этими физиками «возможность» не вывозить отходы на свалку, а сразу на месте превращать их в золото.) Известно, что пары металлов на 99% состоят из атомов. При их совестной конденсации с большим избытком инертного газа на охлаждаемую до 70 К и ниже подложку происходит матричная изоляция отдельных атомов металла, которые при этом становятся доступными для изучения. Следует отметить, что этом метод матричной изоляции используется не только для фиксации атомов, но и отдельных молекул и достаточно широко применяется в спектроскопии. Но, к сожалению, даже в этих условиях происходит довольно интенсивная агрегация атомов. Так, атомарный ванадий существует в виде атомов при отношении концентраций V:Ar=1/104 и температуре ниже 12 К, а при 50 К он уже более чем наполовину агрегирован. Еще выше эти скорости для серебра. Помимо агрегации, если конденсация проведена в другие матрицы, происходит взаимодействие атомов с этими матрицами или просто тривиальное окисление. Так, совместная конденсация паров металла с алифатическими углеводородами или алканами приводит к крекингу последних даже при температурах жидкого азота и образованию МОС с связями М-С или М-Н. Именно поэтому говорить о нанотехнологиях, наночастицах на основе металлов и ряда других неорганических веществ, да и вообще о прочих вещах с приставкой нано, если, конечно, этот разговор идет в кругу ученых, а не в целях рекламы, следует очень осторожно. Еще нет ни одного примера сохранения металлических частиц атомных размеров in vitro – стоит только вынести их из камеры, поднять температуру, заменить инертный газ или вакуум на атмосферный воздух – большинство свойств, присущих именно наночастицам исчезают. Естественно, что наиболее активны все металлы, стоящие в ряду напряжений до водорода. Металлы, стоящие за ним, более устойчивы к процессам окисления, хотя в наносостоянии и они отнюдь не инертны, как в компактном виде. В то же время для УДЧ серебра установлена идентичность оптических свойств материала в вакууме и в среде аргона при низких температурах.
Химическая активность наночастиц может быть использована для синтеза труднодоступных веществ. Таким способом, например, были получены различные ареновые и циклопентадиенильные комплексы переходных металлов, в частности бис-пентаметилциклопентадиенилсамарий – первый представитель мономерных угловых сэндвичей, не содержащих, как и ферроцен, дополнительных лигандов у атома металла. Лишь только когда была показана реальность существования подобных соединений, были разработаны методы их химического синтеза, например по обменным реакциях. В то же время прошло более 30 лет с того момента, когда было обнаружено резкое увеличение проводимости в композите йодида лития с нанооксидом алюминия. Этот эффект используется в миллиардах микробатарей, например для кардиостимуляторов. Тем не менее, еще никто не смог еще дать химически-обоснованного ответа на простейший вопрос, почему гетерогенная смесь LiI и нанокристаллического Al2O3 проявляет столь высокую проводимость и рабочий ресурс? Мне кажется, что таких загадок нанохимия преподнесет еще очень и очень много.
Кластеры с числом атомов от 3 до 12, в которых каждый атом в плотной упаковке является поверхностным, называются малыми. Получение этих веществ направленным синтезом затруднено. Обычно агрегация моно- и биядерных частиц приводит к получению широкого спектра агрегатов различной нуклеарности. При этом, если n=3, то минимум потенциальной энергии на диаграмме Леннарда-Джонса и Морзе отвечает треугольной конфигурации атомов, при n=4 – тетраэдру, при n=5 тригональной бипирамиде, при n=6 бипирамиде с тетраэдром на одной грани, т.н. «шапка», n=7 пентагональной бипирамиде. Последующее присоединение атомов вплоть до n£13 может происходить по «шапочному» типу. Однако все это расчетные модели, а какова реальность, каково строение возможного изомера, реализующегося в том или ином случае, остается не установленным.
Частицы с числом атомов от 13 до 150 имеют размер 8-20 Å и характеризуются появлением в плотной упаковке внутренних атомов. При этом, если отношение внутренних и внешних атомов для n=13 равно 12 (один атом внутренний), то для n=150 приближается к 1. Эти кластеры относятся к средним и большим. Поскольку поверхностные атомы имеют меньше соседей, чем внутренние, нарушается равновесие и симметрия в распределении сил и масс, что приводит к изменению равновесных межатомных расстояний, к сдвиговым деформациям, образованию конфигураций с осями симметрии пятого порядка и икосаэдрической структурой, невозможными для компактного металла. Последнее понятно, так как при образовании этих конформаций атом металла приобретает к.ч.=5, в то время как в ГПУ и ГЦК решетках компактных металлах оно может быть равно только 4. При стабилизации таких кластеров органическими или карбонильными лигандами удалось выделить в индивидуальном состоянии и изучить методом РСтА не слишком большое число соединений, но уже исследованные, в целом подтверждают выводы о строении этих соединений, сделанные на основании общих соображений и модельных представлений. Так, известен скелетный кластерный анион состава [Ni38Pt6 (CO)48]4-, в котором октаэдр из атомов платины окружен 38 атомами никеля. Кластер состава [Cu140Se73(PPh3)30] не относится к скелетным. Он построен из фрагментов селенида одновалентной меди Сu2Se, окруженных фосфиновыми лигандами. Этот пример является уникальным, поскольку других примеров получения монокристаллов кластеров с таким числом атомов пригодных для структурного эксперимента в научной литературе неизвестно. Эта проблема типична для всех многоатомных соединений и до настоящего времени не имеет всеобъемлющего решения. Так, строение другого крупного кластера состава Au55(PPh3)12Cl6 определено только косвенными методами.
Кластеры с размером частиц от 20 до 100 Å называются гигантскими. В них число внутренних и внешних атомов соизмеримо. Считается, что именно к частицам подобного размера приложима приставка нано и они же наиболее интересны для материаловедения. Это объясняется тем, что именно для них наблюдается наибольшее количество аномалий в физических свойствах, именно эти вещества изучаются наиболее интенсивно и именно для них имеется наибольший массив информации (возможно, именно поэтому они и представляются наиболее интересными, чем все прочие кластеры).
Обычно эти вещества получают при нуклеации паров металлов на охлаждаемые поверхности или путем стабилизации в полимерных матрицах или различными лигандами, в качестве которых обычно выступают молекулы растворителя и которые почему-то зачастую не рассматриваются как лиганды.
Строение этих веществ исследовано крайне недостаточно. Известно, что формирование ядра кластера, как и формирование компактного металла, подчиняется правилам, сформулированным в рамках концепции плотной упаковки. Число атомов металлов в плотноупакованном ядре, построенном в виде правильного 12-вершинного многогранника (кубооктаэдра, икосаэдра, антикубооктаэдра) вычисляется по формуле
N=1/3(10n3+15n2+11n+3),
где n – число слоев вокруг центрального атома. Отсюда следует, что минимальное плотноупакованное ядро содержит 13 атомов (1 атом внутренний), затем 55, 147, 309, 561, 923, 1415, 2057, 2869 и т.д. Монослойные молекулярные кластеры, рассмотренные ниже, с 13 атомами металла, например [Rh13(CO)24H3]2- с ядром в виде кубооктаэдра, хорошо известны и многочисленны. С ростом числа атомов их может и не становится меньше, но существенно, затрудняется определение их состава и строения. Так, помимо уже упомянутого двухслойного Au55(PPh3)12Cl6 с размером ~14 Å известен ряд 55 атомных кластеров металлов платиновой подгруппы. В четырехслойном кластере Pt309Phen36O30±10 уже и состав определен с некоторой долей достоверности.
Совершенно уникальный случай связан с гигантским пятислойным кластером состава Pd560Phen60(OAc)180 и диаметром около 20 Å. Его удалось не только выделить в индивидуальном состоянии, но даже изучить его структуру, правда, учитывая вышесказанное, только косвенными методами, но достоверность предложенной структуры весьма велика. Атомы палладия в нем кристаллизуются в 12-ти вершинном полиэдре в виде икосаэдра или кубооктаэдра, молекулы фенантролина располагаются по всем вершинам и ребрам полиэдра, покрывая всю его поверхность, ацетатные группы являются внешнесферными (рис. 57). В настоящее время имеются сведения о получении еще более крупных кластеров – семислойного состава Pd1415phen60O~1100 и восьмислойного Pd2057phen84O~1600.
Радикальное отличие свойств кластерных молекул от свойств компактных металлов убедительно доказано различиями в их электропроводности, теплоемкости и магнитных характеристиках. Так, для кластеров Au55 и Pd561 уже типичным является локализация электронов, формирующих в отличие от металла дискретные энергетические уровни и соответственно не обобществленные молекулярные орбитали. Далее, с уменьшением размера кластера для него становится возможным и легко осуществимым одноэлектронный перенос, поскольку электростатическая энергия электрона становится больше кинетической
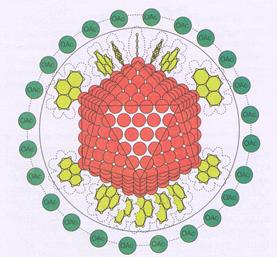
Рис. 57. Модель структуры гигантского кластера Pd560Phen60(OAc)180.
энергии. Как следствие, на вольтамперной кривой U=(I) проявляются ступеньки и плато, тогда как на массивном металле эта зависимость строго линейна.
Частицы с размером от 100 до 300 Å характерны для черней, коллоидных металлов, оксидов, сульфидов и т.п. веществ. Число внутренних атомов в этих частицах уже велико и, например упаковка металлических нанокластеров уже начинает напоминать структуру компактного металла. Растет энергия упругой деформации, которая в некоторый момент может превысить поверхностную энергию и в частицах будут реализовываться два типа упаковки: внутренняя – металлическая и внешняя – икосаэдрическая или ей подобная с осью пятого порядка. Отсюда и из других данных следует, что структура металлической коллоидной частицы, видимо, очень близка хотя бы по «идеологии» строения с структурой вышерассмотренного гигантского кластера Pd560Phen60(OAc)180, размер которого приближается к размеру мельчайших коллоидных частиц: внешние и внутренние слои металлов, ось пятого порядка, двойной электрический слой. К сожалению, структуры коллоидных частиц не установлены так детально, как структура некоторых гигантских кластеров, поэтому прямое их сравнение остается невозможным. Тем не менее исследование первых дает ключ к пониманию особенностей строения и некоторых свойств вторых и указывает на возможные методы их изучения и получения. Среди таких методов хорошо изучены и уже имеют широкое практическое применение методы «золь-гель» технологии, о которых более подробно мы поговорим ниже. Сейчас лишь стоит отметить, что использование в этих технологиях алкоксидов циркония, титана, алюминия, железа и ряда других позволяет получать нанокластерные системы-катализаторы FeO/ZrO2, FeO/TiO2 и другие с различным размером частиц. В то же время он (метод) из-за очень широкого распределения частиц по размерам не дает возможности получать организованные наноструктуры.
В этом отношении более перспективны методы синтеза нанокластеров, использующие прямые и обратные (обращенные) мицеллы (мицеллы – самоорганизующиеся частицы дисперсной фазы золя вместе с окружающей их сольватной оболочкой из молекул (ионов) дисперсионной среды (обычно ПАВ). В прямых мицеллах – обычно наблюдаемых в полярных средах, например в воде, ядро образовано гидрофобными радикалами, а гидрофильные группы ориентированы наружу; в обратных мицеллах -,обычно наблюдаемых в сильно неполярных средах, гидрофильные или полярные группы ориентированы внутрь ядра). В этом отношении наибольший интерес представляют обратные микроэмульсии, обладающие большой подвижностью и большой поверхностью раздела фаз. Это свойство при постоянном столкновении частиц микроэмульсий приводит к непрерывному обмену содержимого их ядер. Так, взаимодействие обратных мицелл на основе Na2S и серебра приводит к получению мицелл Ag2S с узким распределением по размерам. После освобождения от ПАВ-оболочки, обычно достигаемой обработкой тиолами, отделением от растворителя и высушиванием получают нанокластеры размером до 10 нм, но с достаточно узким распределением по размерам. Аналогичным образом получены полупроводниковые нанокластеры, кластеры металлических кобальта, серебра и золота. Однако, здесь необходимо подчеркнуть, что все эти вещества пассивированы тиолами, фосфинами или дитиолами, т.е. опять же избыточная энергия этих образований, как и в молекулярных кластерах, понижается за счет донорно-акцепторного (ковалентного) взаимодействия с внешнесферными молекулами лигандов. Хотя апологеты нанохимии этот факт как-то забывают отметить, рассматривая только ядро кластера. Но в данном вопросе не это главное. Используя специальные приемы, на подложках различного типа из этих равноразмерных нанокластеров удается сформировать как духмерные 2D-структуры, представляющие собой плотноупакованные монослои, в которых, как и в настоящих молекулярных или атомных двухмерных пленках, можно наблюдать дислокации и дефекты, так и трехмерные 3D наноструктуры с свойствами «кристалла», образующими, например, ОЦК-решетку. Таким образом, нанокластеры при строительстве наносистемы, как бы выступают в роли «больших атомов», но, конечно, взаимодействие между ними осуществляется за счет ван-дер-ваальсовых сил.
В настоящее время не установлено, когда в металлических кластерах исчезает икосаэдрическая и остается только типично металлическая упаковка. Возможно, что этот переход затруднен еще и кинетически. Во всяком случае наблюдались частицы металлов размером более 400 Å с осями пятого порядка. Но именно этот переход окончательно стирает грань между кластером и компактным металлом и является той верхней, хотя и очень размытой, границей существования кластерного состояния вещества. Судя по имеющимся данным, вряд ли число атомов, определяющее эту грань, будет одинаковым для различных металлов.
Отсутствие детальных данных по структуре многих металлических кластеров и УДЧ или по современной терминологии наночастиц, особенно в начале ряда и в его конце – в первом случае прежде всего из-за крайне высокой реакционной способности, а во втором из-за отсутствия возможности применения прямых методов исследования структуры вещества, крайне затрудняют определение корреляций «структура-свойство». Тем не менее, имеется довольно много примеров использования этих веществ в практических целях иногда даже без осознания их природы. Например, выше мы уже говорили о «золь-гель технологиях», в которых фигурантами являются коллоидные частицы оксидов металлов. Далее, магнитные жидкости – лиозоли ультрадисперсных магнитных частиц. С уменьшением размера ферромагнитной частицы до величины порядка 100 Å их магнитные свойства начинают существенно отличаться от свойств компактного металла (именно в этих отличиях и заключается уникальность истинных наноматериалов), поскольку частица ниже некоторой критической размерности из многодоменной становится однодоменной. Это приводит к тому, что все они намагничиваются однородно и при этом начинают проявлять супермагнитные свойства. Видимо образование подобных частиц является и причиной уникальных свойств магнитов на основе сплава Nd-Fe-B. Лиозоли с подобными свойствами применяются при изготовлении устройств, герметизирующих выходные валы, кабели или другие детали в стенке основного корпуса.
Особенно впечатляющая демонстрация размерных эффектов наблюдается в полупроводниковых нанокристаллах (обычно называемых квантовыми точками) с размером меньшим размера боровского радиуса экситона (квазичастица, соответствующая электронному возбуждению в кристалле диэлектрика или полупроводника, мигрирующему по кристаллу в виде волны, но не связанному с переносом электрического заряда и массы). По мере уменьшения размера кластера происходит увеличение ширины запрещенной зоны, определяемой задержкой электронно-дырочной пары, генерируемой фото- или радиационно-химическими способами, в ограниченном объеме пространства. Это приводит к тому, что в некоторых полупроводниках, относящихся к классу оптических преобразователей, рекомбинационная люминесценция сдвигается в область более высоких энергий (голубая область). Например, нанокристаллы CdSe покрытые одим-двумя слоями ZnS при дискретном увеличении размера с 23 до 55 Å меняют цвет с голубого через зеленый и оранжевый до ярко-красного.
Определенные и вполне обоснованные надежды и прямые успехи связаны с применением кластерных частиц металлов в катализе. На это указывают многочисленные успешного применения УДЧ носители благородных металлов, нанесенных на минеральные носители, черней и т.п. Конечно, в каталитической реакции «работают» уже не отдельные изолированные кластеры, а продукты их реакции с подложкой, субстратом, растворителем, если он применяется, в конце концов с примесями, избавиться от которых на 100 % просто невозможно. Однако исходный материал для получения реально работающего катализатора – кластер и размерный и структурный факторы в гетерогенном катализе вещь еще непознанная, но явно имеющая место. Сейчас методом молекулярных пучков можно направленно получать кластеры любой нуклеарности, а иногда определять и их структуры, а затем изучать зависимости реакционной способности в той или иной реакции от числа атомов в нем. Так, установлено, что атом Re не реагирует с метаном, в то время как Re3 весьма активен. Линейные Cu3 и Ni3 не реагируют с водородом и метаном, а треугольные и Ni13 высокоактивны. Кластеры Соn с n=3-5 и 10-18 реагируют с водородом с диссоциацией последнего, а с n=6-9 абсолютно инертны. В кластерном состоянии даже золото теряет свое «благородство» и в реакции СО+О2 → СО2 высокоактивны кластеры с n=8,11,15, 18. Таких примеров сейчас известно множество, хотя понять еще не значит создать - это задача другого порядка, но отправная точка существ
Дата добавления: 2016-07-18; просмотров: 3995;











