Невалентные и специфические взаимодействия
Межмолекулярные невалентные взаимодействия (МНВ) протекают без разрыва старых или образования новых химических (валентных) связей, т.е. без изменения степеней окисления или валентностей реагирующих атомов, входящих в состав взаимодействующих молекул. Эти взаимодействия зачастую, не определяя постоянства состава химического соединения в разлияных фазовых состояниях, определяют многие его физические, химические и структурные свойства. В частности, отклонение в свойствах реальных газов от идеальных, свойств воды от свойств аналогов по 16 группе, сам факт существования молекулярных кристаллов – все это проявление невалентных сил, часто называемых обобщенным термином ван-дер-ваальсовые силы, что не совсем правильно. Основу этих сил составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы с электронами и ядрами другой, хотя известно достаточно много примеров, когда это взаимодействие затрагивает и валентные орбитали (наиболее яркое из них проявляется в ионной связи).
Энергия этого взаимодействия зависит от расстояния между молекулами, на этой же основе проводится и классификация МНВ. При больших расстояниях между молекулами, заметно превышающими размеры самих молекул, говорят о электростатическом, поляризационном (индукционном) и дисперсионномвзаимодействиях, хотя подобное деление следует, как и описание ковалентной химической связи по Льюису, рассматривать как чисто феноменологическое. В действительности все типы взаимодействия обусловлены большими или меньшими изменениями электронных плотностей в сближающихся атомах или молекулах, т.е., в конце концов, кулоновскими силами. Но опять же не все и не всегда можно трактовать так однозначно, поскольку при подобных взаимодействиях возможно и частичное ковалентное связывание. Например, существуют водородные связи с энергией 2-3 ккал/моль и связи с энергиями 15-20 ккал/моль, которые также являются, безусловно, водородными.
В случае электростатического взаимодействиянаиболее прочные связи наблюдаются при ион-дипольном характере связывания (50-200 кДж/моль), возникающем, например при растворении солей типа поваренной соли в полярных растворителях – воде, т.е. по существу речь идет о эффекте сольватации или гидратации катиона металла. Это очень близко по смыслу к образованию д.-а. или ионной связи. Однако в отличие от них ион-дипольное взаимодействие существенно меньше по энергии, и изменяется она не обратно пропорционально расстоянию между взаимодействующими зарядами, как в ионных веществах, а обратно пропорционально квадрату расстояния. Поэтому, например, при кристаллизации из водных растворов поваренная соль выделяется в негидратированном состоянии, а хлориды РЗЭ в виде гидроксокомплексов с прочной донорно-акцепторной связью Ln←О или даже оксогидроксо связями.
При диполь-дипольном взаимодействии, наблюдаемом, например, в жидкой воде, энергия еще меньше (5-50 кДж/моль) и изменяется обратно пропорционально кубу расстояния между взаимодействующими диполями.
К этому же типу взаимодействия можно отнести π-π стэкинг взаимодействие. Электростатическое π-π-стэкинг-взаимодействие (0-50 кДж/моль) часто осуществляется между ароматическими кольцами, когда одно из них или часть его испытывает некоторый электронный дефицит, а другое, наоборот, некоторый избыток. Известно два основных типа π-стэкинга –«плоскость к плоскости» и «торец к плоскости», хотя известны и варианты этих крайностей. Пример первого типа – взаимодействие графеновых слоев в графите. Второго - в кристаллическом бензоле (структура типа «елочка»). Но это примеры макроуровня. Есть примеры более тонкой роли стэкинга, когда его возникновение приводит к радикальному изменению функциональных свойств молекул. Так, в бипиридильно-дииминовом биядерном комплексе иридия и европия с фторными заместителями у бензольных колец происходит полное гашение люминесценции атома европия, дающей красный цвет, что связано с эффективным π-π стэкингом ароматического электрон-обогащенного нафтильного фрагмента с электрон-обедненным F2PhPy фрагментом, обеспеченном еще и подвижностью метиленовой группы (рис. ). Но введение объемных CF3-групп создает такие стерические затруднения, что π-стекинг становится невозможным, появляется красная люминесценция, которая при смешивании с си ней от атома иридия впервые в истории изучения этого явления дает белую! люминесценцию. Вот, что значит такое слабое невалентное взаимодействие типа стэкинг.
Поляризационное взаимодействия проявляется в Ван-дер-ваальсовых молекулах. Как правило, это слабосвязанные комплексы атомов, радикалов, ионов или молекул друг с другом или между собой (<5 кДж/моль), например He2, HCl·He, Ca·Mg, He·NH3 и много других, взаимодействие в которых осуществляется за счет поляризации электронного облака в поле соседних ядер. Вандерваальсовы молекулы являются важнейшими и надежными источниками для определения величин атом-атомных потенциалов, т.е. функций, определяющих организацию кристаллов в макромолекулах, полиморфизм,
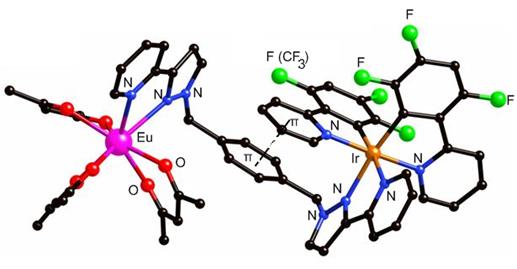
Рис. Структура биядерного иридий-европиевого комплекса с белой люминесценцией.
самоорганизацию молекулярных ансамблей, а отсюда практически все аспекты супрамолекулярной химии, саморепликацию биомолекул и, соответственно, всю биохимию. Поэтому эти величины очень широко используются в современной науке для расчетов химической и молекулярной динамики жидкостей, стекол, макромолекул, расчета межмолекулярного переноса энергии и т.п.
Мы видим, что все рассмотренные примеры, в общем-то, относятся к чистой физике. Это и понятно, поскольку все физические свойства, определяемые ван-дер-ваальсовыми комплексами, проявляются на макроуровне и их исследования не представляют непреодолимых экспериментальных сложностей. Несколько хуже, в силу крайне высокой лабильности и ничтожности энергии связи между партнерами примерно равными kT, обстоят дела с выяснением вопроса о роли этих веществ в химических процессах. Но последние исследования однозначно и положительно отвечают на этот вопрос – да, участвуют и как первая стадия очень многих парных взаимодействий фиксируются современной спектроскопической техникой.
Дисперсионноевзаимодействие (взаимодействие наведенный диполь-мгновенный диполь) определяется квантово-механическими флуктуациями электронной плотности атомов или молекул. Мгновенное, кратковременное и неравновесное распределение электрического заряда, которое приводит к появлению мгновенного дипольного или в общем мультипольного момента, который в свою очередь индуцирует электрические мультипольные моменты в других частицах. Энергия взаимодействия этих мультиполей обратно пропорциональна расстоянию в шестой и седьмой степенях, т.е. является одной из самых слабых среди прочих энергий МВ, и зависит от размеров частиц и числа электронов, участвующих в образовании мгновенных диполей. Например, т. кипения жидкого водорода возрастает в ряду H2-D2-T2 и в величинах этого роста есть вклад дисперсионного взаимодействия, которое наблюдается для всех молекул, а для неполярных и малополярных является основным среди прочих МНВ.
Полная энергия МНВ равна алгебраической сумме энергий всех вышерассмотренных взаимодействий (без учета ОВ). По сравнению с энергией ковалентных или ионных связей эта суммарная энергия МНВ меньше на порядок, но она отнюдь не близка 0. Так, энергия ковалентной связи Cl-Cl =240 кДж/моль, а энергия сублимации твердого хлора ЕМВ =25 кДж/моль. В целом эти типы взаимодействия определяют множество свойств газов и твердых тел, например вязкость газов, конденсацию и кристаллизацию, и другие фазовые переходы, критические точки вещества, флуктуации плотности и т.д.
Помимо межмолекулярных невалентных взаимодействий в химии выделен особый класс специфических взаимодействий, имеющих огромное значение практически во всех ее разделах и часть из которых мало отличимая по энергии от рассмотренных выше МНВ, а другая часть как бы занимает промежуточное положение между химическим и межмолекулярным невалентным взаимодействиями. К первой и наиболее известной относится водородная связь (4-120 кДж/моль), определяющая все известные аномалии воды и выделенная в этот класс из-за сильного взаимодействия различных колебательных степеней свободы в комплексах, а не из-за существенного отличия по энергии от МНВ. Для объяснения причин ее образования могут применяться те же схемы МО, что и для многоцентровых связей в бороводородах или других гидридных системах. Но при этом следует иметь ввиду, что по энергиям водородные и мостиковые гидридные связи существенно различны. Поэтому последние образуют довольно прочные химические соединения, а первые молекулярные комплексы.
Достаточно редкая разновидность водородной связи – агостическая связь, как правило, наблюдается в металлорганических соединениях переходных металлов и возникает за счет переноса электронной плотности от атома водорода, связанного с какой-либо группой (обычно длинной или разветвленной алкильной) внутри одной молекулы на вакантные орбитали переходного металла. Образование этой связи описывается той же схемой, что и классические водородные и гидридные мостиковые связи. Агостическая связь играет чрезвычайно важную роль в процессах активации связей С-Н и С-С, в металлокомплексом катализе, процессах, сопровождающихся восстановительным элиминированием или окислительным присоединением.
Молекулярные комплексы с переносом заряда (донорно-акцепторные комплексы, молекулярные соединения), в которых при возбуждении в электронных спектрах, как правило, появляется новая более мощная полоса поглощения, указывающая на резкое увеличение степени переноса заряда, например в комплексе молекулярного иода (акцептор) с молекулой третичного амина (иногда по разным причинам эта полоса не проявляется). Сам эффект возникает за счет перекрывания электронных оболочек молекул, если их сродство к электрону различно. Перенос электрона можно рассматривать как “далеко зашедшую” поляризацию, однако энергия, связанная с этим переносом, по своему абсолютному значению может быть существенно меньше энергии поляризации и экспоненциально стремится к нулю с увеличением расстояния между взаимодействующими молекулами.
По типу связи МК очень условно можно классифицировать как электростатические, поляризационные и КПЗ. Перенос электрона может быть большим или меньшим. В соответствии с этим образующиеся комплексы могут быть стабильны, и выделены в индивидуальном состоянии, например комплексы галогенидов алюминия (v-акцепторы) с аминами (n-доноры) с энтальпиями образования 220-280 кДж/моль, или нестабильны и существовать только в разбавленных растворах, например комплекс иода (s-акцептор) с сульфидами (n-доноры) с энтальпиями образования 1-2 кДж/моль или еще более слабый с четыреххлористым углеродом (s-донор). Однако глубокий перенос электрона(ов) в основном состоянии достаточно редок и наблюдается, например при взаимодействии p-доноров с p-акцепторами (графит с хлоридом железа), и приводит к образованию ион-радикальных пар или ион-радикальных солей, называемых органическими проводниками. Следует отметить, что в действительности характер данного взаимодействия существенно сложнее, поскольку в межслоевое пространство внедряется отнюдь не нейтральная молекула хлорного железа, а ионы, возникающие в ходе реакции ионизация хлористого железа с свободным хлором (понятие самовнедряющихся и несамовнедряющихся веществ).
Молекулярные комплексы, образованные за счет резонансного взаимодействия двух одинаковых молекул, одна из которых находится в возбужденном состоянии, а другая в основном, называются эксимерами. При подобном же взаимодействии двух разных молекул образуются эксиплексы. Эти комплексы определяют флуоресцентные свойства вещества, кинетику и механизм некоторых фотохимических реакций.
Как следует из приведенных примеров, каждый тип межмолекулярных или специфических взаимодействий определяет образование того или иного типа молекулярных комплексов. Их интегрирование приводит к формулировке относительно нового понятия в химии – супрамолекулярной химии. Предмет этой химии пока находится на стадии становления и трудно предугадать, каковы будет его границы. Однако уже сейчас вполне очевидно, что любое, даже очень сильное взаимодействие начинается с образования неких слабо связанных молекулярных или ионных комплексов, которые в химии называются самыми разнообразными терминами, отражающими специфику предмета, в рамках которого они рассматриваются. Это может быть переходное состояние, живущее пико- или даже фемто – секунды и еще 10-15 лет тому назад - состояние чисто гипотетическое, а сейчас с развитием методов лазерной химии экспериментально исследуемое, или интермедиат, который в ряде случаев может быть вполне устойчивым при обычных условиях и даже выделен в индивидуальном виде, хемо- или адсорбата и т.п. Другой вопрос, надо ли их выделять в отдельный предмет или оставить там, где они лучше всего отражают специфику химической реакции в целом. Ответ на этот вопрос даст время, которое безжалостно уничтожает лишнюю сущность.
Дата добавления: 2016-07-18; просмотров: 4415;











