Электронные формулы элементов. Электронные семейства. АВЗ.
Электронная формула элемента (электронная конфигурация атома) описывает распределение электронов по энергетическим уровням и подуровням, существующим в электронном облаке. Она записывается в порядке возрастания главного квантового числа, в отличие от порядка заполнения атомных орбиталей, который записывается по ходу возрастания суммы (n+l). Первая цифра в формуле равна n, буква после нее соответствует l, а правый верхний индекс равен числу электронов в этом состоянии.
Электронную формулу можно строить на основании положения элемента в таблице Менделеева. Построение начинается с начала каждого периода, номер которого будет совпадать со значением n.
Рассмотрим электронные формулы некоторых элементов (в скобках указано распределение электронов по уровням)
3Li – 1s22s1 (2 1), 6C – 1s2 2s2 2p2 (2 4),
17Cl– 1s2 2s2 2p6 3s2 3p5 (2 8 7), 25Mn – 1s2 2s2 2p6 3s23p6 3d5 4s2 (2 8 13 2),
56Ba 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 6s2 (2 8 18 18 8 2),
64Gd– 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f7 5s2 5p6 5d1 6s2 (2 8 18 25 9 2),
91Pa64 – 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f2 6s2 6p6 6d1 7s2 (2 8 18 32 20 9 2),
104Ku – 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d2 7s2 (2 8 1 8 32 32 10 2).
Существует еще одна удобная форма записи распределения электронов в атоме. Каждую орбиталь (квантовую ячейку) рисуют в виде квадратика (горизонтальной линии), а расположенные в ней электроны изображают в виде стрелок. Свободная ячейка означает свободную орбиталь, которую может занимать электрон при возбуждении атома. Получается картинка, называемая орбитальной (энергетической) диаграммой. В отличие от электронных формул, здесь используются не два, а все четыре квантовых числа.
Электронные подуровни, также как и уровни, различаются по энергии. Они располагаются на разной энергетической «высоте».
Поэтому орбитали – квадратики иногда рисуют так, чтобы орбитали более высокого подуровня располагались выше орбиталей более низкого подуровня. Например, три одинаковых p-орбитали рисуют выше s-орбитали.

| 3d | |
| 3р | ||
| 3s | Часть диаграммы |
В зависимости от того, на какой подуровень попадает последний электрон, все элементы делятся на четыре семейства:
s-элементы – I-II группа главная подгруппа, а также водород и гелий;
p-элементы – III-VIII группа главная подгруппа, кроме водорода и гелия;
d-элементы – все побочные подгруппы I- VIII групп;
f-элементы – актиноиды и лантаноиды.
Атомная валентная зона (АВЗ) – это часть электронной оболочки, которая может перестраиваться по ходу образования химической связи.
АВЗ включает, как правило, внешний s– подуровень (ns) и тот подуровень, который заполняется у данного элемента.
| Семейство | АВЗ | Максимально возможная валентность |
| s | ns | 1-2 |
| p | ns np | 1-8 |
| d | (n-1)d ns | 1-8 |
| f | (n-2)f ns | 1-8 |
Оставшаяся часть электронной оболочки в совокупности с ядром называется атомным остовом или химическим ядром.
Если на валентных энергетических уровнях имеются вакантные АО, то при возбуждении атома (получении ими порции энергии) становится возможным «разъединение» валентных электронов, то есть их переходы с тех подуровней, где все АО заняты полностью (¯) или частично (¯) на другие валентные подуровни того же уровня, имеющие незаполненные АО. Энергия, затрачиваемая на распаривание электронов, незначительна и окупается энергией, выделяющейся при образовании связи. При этом с тех АО, которые в основном (соответствующем минимальной энергии атома) состоянии были заняты полностью, «уходит» по одному электрону последовательно, т.е. возможно несколько возбужденных состояний. Возбуждение меняет валентное состояние атома (число его неспаренных электронов).
Пример.
Определите возможные валентные состояния и укажите семейство для элементов с порядковыми номерами 11, 20, 8, 34, 22.
Запишем электронные формулы этих элементов, подчеркнем их АВЗ и для нее построим энергетическую диаграмму:

11Na 1s22s22p63s1 На внешнем энергетическом уровне у натрия находится только один электрон, поэтому он может проявлять только одну валентность, равную единице (В=1).
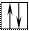 20Ca 1s22s22p63s23p64s2 На внешнем энергетическом уровне у кальция находится два спаренных электрона. А поскольку с точки зрения спин–валентной теории участвовать в образовании связи могут только свободные электроны, то в стационарном состоянии валентность кальция будет равна нулю (В=0).
20Ca 1s22s22p63s23p64s2 На внешнем энергетическом уровне у кальция находится два спаренных электрона. А поскольку с точки зрения спин–валентной теории участвовать в образовании связи могут только свободные электроны, то в стационарном состоянии валентность кальция будет равна нулю (В=0).

В таком состоянии валентность кальция равна двум (В*=2).
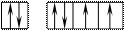
8O 1s22s22p4
Поскольку здесь нет свободного d– подуровня на втором энергетическом уровне, то электроны распаривать некуда и кислород может быть только двухвалентен.
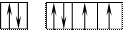
34Se 1s22s22p63s23p63d104s24p4 В=2.
Но, не смотря на то, что и селен, и кислород стоят в одной группе, имеют сходное строение электронной оболочки и должны проявлять одинаковую валентность, оказывается, что у селена имеется свободный d– подуровень на четвертом уровне, куда могут распариваться валентные электроны.
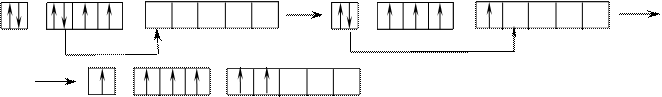
В этом случае В*=4; 6.

 22Ti1s22s22p63s23p63d24s2.
22Ti1s22s22p63s23p63d24s2.
На первый взгляд, в атоме титана имеется два неспаренных электрона на предвнешнем d-подуровне, которые могли бы вступить в образование связи. Но, на самом деле, они экранируются внешними спаренными s-электронами, поэтому в стационарном состоянии валентность титана равна нулю. В возбужденном состоянии внешние s-электроны четвертого уровня распариваются (один из них переходит на р-подуровень того же уровня). Поскольку сразу два электрона получили некоторый избыток энергии, то они оба вступают в химическое взаимодействие, то есть В*=2.
 Что касается d-электронов на третьем энергетическом уровне, то они расположены ближе к ядру и поэтому обладают меньшим запасом энергии. Вследствие этого они менее активны и в образование связи могут вступать по одному.
Что касается d-электронов на третьем энергетическом уровне, то они расположены ближе к ядру и поэтому обладают меньшим запасом энергии. Вследствие этого они менее активны и в образование связи могут вступать по одному.
То есть В*=3; 4. Но, поскольку не все теоретически определенные валентности для элементов d-семейства обнаруживаются экспериментально, для них целесообразно указывать интервал валентностей. Например, В*=2-4.
Первые два элемента (Na и Са) относятся к s-семейству, поскольку у них последним застраивается s-подуровень, вторые два элемента (O и Se) относятся к p-семейству, поскольку у них последним застраивается p-подуровень, титан относится к d-семейству, поскольку у него последним застраивается d-подуровень.
Дата добавления: 2020-08-31; просмотров: 587;











