Порядок выполнения работы
Часть 1. Определение ПОЕ смолы КУ-2.
Для проведения работы необходимы:
Ø хроматографическая колонка, заполненная 5 г смолы КУ-2;
Ø рН-метр типа рН-340;
Ø градуированные пробирки;
Ø мерный цилиндр емкостью 250 мл;
Ø стакан емкостью 50 мл;
Ø бюретка;
Ø 3М раствор НС1;
Ø 1,5М раствор NaCl;
Ø 0,2 М раствор KОН;
Ø фенолфталеин.
В работе используется хроматографическая колонка, устройство которой изображено на рис. 3.7.
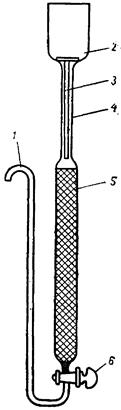
рисунок 3.7 – Хроматографическая колонка:
1 – отводная трубка; 2 – емкость; 3 – стеклянный стержень; 4 – трубка; 5 – колонка с ионитом; 6 – кран.
Рабочий объем колонки 5, представляющей трубку с внутренним диаметром 10 мм и высотой 200 мм, заполнен сульфокатионитом КУ-2 с размером зерен 0,4–0,6 мм. Емкость 2 для элюента соединена с рабочим объемом колонки трубкой 4, благодаря которой создается избыточное гидростатическое давление, необходимое для прохождения раствора через слой ионита. Тонкий стеклянный стержень 3 способствует заполнению трубки раствором. Скорость пропускания раствора регулируется краном 6.
Предварительно переводят ионогенные группы катионита в Н+-форму, пропуская через колонку 40 мл 3 М раствора НС1. Для этого 20 мл кислоты наливают в емкость 2 и через несколько секунд (после полного выхода пузырьков воздуха из трубки 4) открывают кран 6 и устанавливают необходимую скорость вытекания раствора (1 капля в 1 с). Когда уровень раствора опустится до нижней части трубки 4, закрывают кран 6 и наливают в емкость 2 новую порцию кислоты. Снова устанавливают оптимальную скорость элюирования.
Затем смолу промывают водой до тех пор, пока рН в вытекающем растворе не будет иметь значение 3,5–4,0. Для этого потребуется около 50 мл воды. Рекомендуется измерять рН после того, как из колонки выйдет 25–30мл раствора. Отбирают аликвотные части по ~5 мл и анализируют их с помощью рН-метра.
Через подготовленную таким образом колонку пропускают 1,5 М раствор NaCl. Элюат собирают порциями по 3–4 мл в градуированные пробирки. В каждой пробирке определяют точный объем пробы и измеряют рН. Процесс вытеснения ионов Н+ из катионита проводят до тех пор, пока рН элюата не будет иметь значение 2,7–3,0 Полученные результаты записывают в таблицу (см. табл. 3.5) и строят выходную кривую, т. е. зависимость рН от объема вышедшего элюата (суммарный объем проб).
Таблица 3.5 – Экспериментальные данные по определению ПОЕ смолы КУ-2.
| Номер пробы | Объем пробы, мл | рН пробы | Суммарный объем элюата V, мл |
Все растворы, содержащие вытесненную из смолы кислоту (остатки элюата в пробирках, растворы из кюветы рН-метра, вода после промывки пробирок и кюветы рН-метра), объединяют, сливают в мерный цилиндр и измеряют объем Vобщ. Из полученного раствора отбирают пипеткой аликвотную часть 10 мл и титрованием 0,2 М раствором KОН в присутствии фенолфталеина определяют концентрацию кислоты в объединенном растворе. Полную обменную емкость катионита КУ-2 рассчитывают по формуле (3.33).
Часть 2. Определение константы ионного обмена
Для проведения работы необходимы:
Ø хроматографическая колонка со смолой КУ-2;
Ø рН-метр типа рН-340;
Ø фотоэлектрический колориметр (ФЭК-56М);
Ø градуированные пробирки;
Ø стакан емкостью 50 мл;
Ø 3 М и 0,6 М растворы НС1;
Ø раствор соли кобальта(II) или меди(II) концентрацией 30 мг/мл.
Предварительно катионит переводят в Н+-форму, пропуская через него 40 мл 3 М НС1 (см. определение ПОЕ смолы КУ-2). Затем смолу промывают водой до тех пор, пока рН выходящего из колонки раствора не будет равно ~3. После этого в свободную емкость 2 (см. рис. 3.7) колонки вносят 1 мл 0,6 М раствора НС1, открывают кран 6 и дают впитаться кислоте в верхний слой смолы. Затем в емкость 2 наливают воду и собирают вытекающий раствор в пробирки порциями по ~ 1,5 мл (объем уточняют по градуировке пробирок) и измеряют значение рН в каждой пробе.
Строят график зависимости рН от объема вышедшего элюата и по минимальному значению рН определяют свободный объем колонки V0.
Через колонку пропускают 4 мл раствора соли меди или 2,5 мл раствора соли кобальта. Затем через колонку пропускают 3 М НС1 со скоростью 1 капля за 2 с для элюирования адсорбированных в верхней части слоя смолы ионов М2+. Порции элюата по мл собирают в пробирки и с помощью электрофотоколориметра определяют их оптическую плотность D, используя для растворов меди светофильтр с максимумом светопропускания при 620 нм, а для растворов кобальта – 480 нм. Раствором сравнения служит вода. Полученные результаты записывают в таблицу (см. табл. 3.5).
Таблица 3.5 – Экспериментальные данные по определению константы ионного обмена.
| Номер пробы | D пробы | Суммарный объем элюата V, мл |
Строят график зависимости D от V (рис. 3.8) и по максимальному значению оптической плотности находят объем элюата V*макс, вышедшего из колонки от начала элюирования до появления максимума на выходной кривой, и по уравнению (3.39) рассчитывают значение V*макс. Константу ионного обмена рассчитывают по уравнению (3.38), при этом за концентрацию [Н+] принимают концентрацию НС1 в элюате; значение ПОЕ определяют в первой части работы.
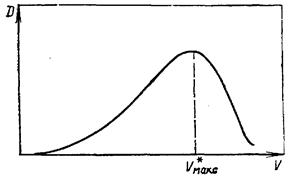
Рисунок 3.8 – Зависимость оптической плотности от объема элюата.
Часть 3. Разделение смеси ионов Си2+ и Со2+
Для проведения работы необходимы:
Ø хроматографическая колонка с ионообменной смолой КУ-2;
Ø фотоэлектрический колориметр (ФЭК 56М);
Ø градуированные пробирки;
Ø стакан емкостью 50 мл;
Ø раствор соли кобальта (II) и соли меди(II);
Ø 3 М раствор НС1;
Ø 1,5 М раствор КС1;
Ø раствор, содержащий 0,15 моль/л однозамещенного цитрата калия и 0,15 моль/л двузамещенного цитрата калия.
Катионит предварительно переводят в K+-форму (см. определение ПОЕ смолы КУ-2). Для этого через колонку со скоростью 2 капли в 1 с пропускают последовательно растворы: 20 мл 3М НС1, 40 мл 1,5М KС1, 20 мл Н2О. Затем около 4 мл разделяемой смеси ионов меди и кобальта пропускают через смолу и колонку промывают небольшим количеством (10–15 мл) воды. При этой операции ионы Сu2+ и Со2+ поглощаются в верхней части катионита (этот слой приобретает бурую окраску). В емкость 2 (см. рис. 3.7) наливают раствор цитрата калия, открывают кран колонки и собирают элюат в пробирки по 4,0–4,5 мл. Скорость элюирования должна соответствовать 1 капле в 1 с.
Периодически добавляют в емкость 2 десорбент и проводят элюи-рование до полного выхода кобальта из колонки, о чем свидетельствует исчезновение оранжевой окраски элюата. С помощью фотоэлектроко-лориметра измеряют оптическую плотность D каждой порции элюата со светофильтром 620 нм (для определения содержания меди) и затем со светофильтром 480 нм (для определения содержания кобальта). В качестве раствора сравнения используют воду. По калибровочным графикам, построенным с применением стандартных растворов солей меди и кобальта, находят концентрации Сu2+ и Со2+ в каждой пробе. Полученные результаты записывают в таблицу (см. табл. 3.7) и строят выходную кривую хроматографического разделения Си2+ и Со2+ (см. рис. 3.6).
Таблица 3.5 – Экспериментальные данные по хроматографическому разделению Сu2+ и Со2+
| Номер пробы | D пробы | Суммарный объем элюата V, мл |
| Номер пробы | Объем пробы, мл | D при 620 нм | [Сu2+], г/л | D при 480 нм | [Со2+], г/л | Объем элюата V, мл |
По уравнению (3.41) рассчитывают параметр относительной степени комплексообразования ионов меди и кобальта; v0 находят по данным определения константы ионного обмена.
Используемая литература
1. Современный словарь иностранных слов: /Изд-во «Рус. яз.» – М.: Рус. яз., 1993. – 740 с.
2. Химическое загрязнение почв и их охрана: Словарь – справочник /Д.С. Орлов, М.С. Малиннна, Г.В. Мотузова и др. – М.: Агропроиздат, 1991 – 303 с.
3. Сергеев Б.Ф. Жизнь океанских глубин – М.: Молодая гвардия, 1990 – 301 с.
4. Толковый словарь по химии и химической технологии. Основные термины /С. М. Баринов, Б. Е. Восторгов, Л. Я. Герцберг и др. Под редакций Ю.А.Лебедев а. – М.: Рус.яз., 1987 – 528 с.
5. Конюхов А.И. Геология океана: загадки, гипотезы, открытия, – М.: Наука, 1989 – 208 с.
6. Филипов Е.М. Мировой океан раскрывает свои тайны – Киев: Наук. думка, 1990 – 184 с.
7. Кутырин И.М. Охрана воздуха и поверхностных вод от загрязнения. – М.; Наука, 1980 – 86 с.
8. Химическая энциклопедия: в 5 т.: т. 1: А-Дарзана /Ред-кол. – Кнунянц И.А. (гл. ред) и др. – М.: Сов. энцикл., 1988 – 623 с.
9. Фридрихсберг Д. А. Курс коллоидной химии – Л,: Химия, 1974 – 352 с.
10. Захарченко В. Н. коллоидная химия. - М.: Высш. шк., 1989. - 238с.
11. Дулицкая Р. А., Фельдман Р. И. Практикум по физической и коллоидной химии. – М.: Высш. школа, 1978 – 296 с.
12. Лабораторные работы и задачи по коллоидной химии /Под редакцией Ю.Г. Фролова, А. Г. Градского и др. - М.: Химия, 1986. - 216 с.
13. Киселева Е.В., Каретников Т.С., Кудряшов И.В. Сборник примеров и задач по физической химии. – Изд-во 5-ое перераб. и допол. – М.: Высшая школа, 1983. (и др. годы издания).
14. Зимон А. Д., Лещенко Н.Ф. Коллоидная химия. – М.: АГАР, 2001 –320 с.
15. Воюцкий С.С. Курс коллоидной химии (Поверхностные явления и дисперсные системы). - М.: Химия, 1975. - 400 с.
16. Фролов Ю.Г. Курс коллоидной химии. - М.: Химия, 1982. - 340с.
Дата добавления: 2020-07-18; просмотров: 871;











