ЛАБОРАТОРНЫЕ РАБОТЫ
Работа 14 «Изучение адсорбции уксусной кислоты на угле»
Задание. 1. Количественно определить адсорбцию уксусной кислоты на угле. 2. Построить изотерму адсорбции. 3. Определить графически константы в уравнении Фрейндлиха - Бедекера,
Выполнение работы. Приготовить исходный 0,4 н раствор СН3СООН и оттитровать его 0,1 н NaOH с фенолфталеином. Приготовить разбавлением исходного раствора по 100 мл растворов следующих концентраций (г-экв/л): 0,2; 0,1; 0,05; 0,025 и 0,0125. В шесть сухих пронумерованных колб с пробками отвесить по 1,5 г активированного угля на технических весах. В каждую колбу влить по 50 мл приготовленных растворов кислоты. Интенсивно взболтать и оставить стоять на 20 – 30 мин, чтобы установилось равновесие. Взбалтывать растворы каждые 3–5 мин. Приготовить шесть сухих колб с воронками, в которые поместить сухие складчатые фильтры. Растворы отфильтровать, отбрасывая первые порции фильтра (3–5 мл), и фильтрат оттитровать. Титровать каждый раствор до и после адсорбции 2 – 3 раза, используя одинаковые объемы кислоты. Из первых двух растворов с большей концентрацией взять для титрования по 10 мл кислоты, а из последних трех – по 20 мл.
Результаты занести в таблицу по форме:
| До адсорбции | После адсорбции | ||||
| Объем кислоты, мл | Объем щелочи, мл | Концентрация кислоты, мл | Объем кислоты, мл | Объем щелочи, мл | Концентрация кислоты, мл |
Массу адсорбированной кислоты рассчитать по формуле
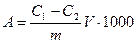
где С1 – исходная концентрация кислоты, моль/л; С2 – равновесная концентрация кислоты, моль/л; V – объем раствора, взятый для адсорбции, л; m – масса адсорбента, г.
Вычислить lgA и lgC и построить график, откладывая lgA на оси ординат, а lgc – на оси абсцисс. Рассчитать и записать значение k и n (при расчете n учитывать значения, нанесенные на (координатах).
Работа 15 «Определение полной динамической емкости катеонита»
задание.Определить обменную емкость катионита и анионита. 2. Построить выходные кривые.
Выполнение работы.Загрузить в хроматографическую колонку длиной 25 см и диаметром 10 мм (см. рисунок 3) определенную навеску тщательно отмытого катионита КУ-1 или КУ-2. На дно колонки поместить тампон из стеклянной ваты. Налить в колонку взболтанную смесь катионита и дистиллированной воды. Постепенно спустить лишнюю воду через кран. Слой катионита должен быть не выше половины колонки а слои воды над ним около 3–4 см. Закрепит колонку строго вертикально. Соединить верхнюю часть колонки с напорной склянкой Мариотта для равномерной подачи раствора в колонку. Склянку заполнить 0,05 н CuSo4. Под колонку поместить мерный цилиндр на 25 мл, открыть кран и начать пропускать раствор CuSo4 через слой катионита. Скорость истечения раствора (3 – 4 мл/мин) регулировать краном. Собирать по 25 мл вытекающего раствора, подставляя под кран следующий цилиндр. Определить в каждой пробе иодометричеоки содержание Cu2+. Для этого 25 мл раствора перенести в коническую колбу на 100 мл,добавить 4 мл 2 н Н2So4, 10 мл 10 %-ного KI и титровать 0,05 н. Na2S2О3 в присутствии крахмала до обесцвечивания. Первые порции титровать из микробюретки.
Опыт закончить, когда концентрация ионов Cu2+ в фильтрате сравняется с содержанием их в исходном растворе. По разности концентраций ионов Cu2+ в исходном растворе и в фильтрате рассчитать число миллиграмм-эквивалентов меди, которое поглотилось ионитом из каждой порции фильтрата. Рассчитать поглощенное количество меди на единицу массы ионита (в пересчете на абсолютно сухое вещество). По данным опыта построить выходную кривую для ионов Cu2+; на оси абсцисс – объем фильтрата (мл), а на оси ординат – концентрацию Cu2+ (мг-экв/л) в фильтратах. Графически определить обменную емкость – полную и до проскока.
Для определения объемной емкости анионита колонку заполнить определенным количеством набухшего ионита АВ-17 или ЭДЭ-10 в ОН– –форме. Анионит насытить 0,1 н. раствором КС1. Концентрацию ионов С1– определять аргентометрически, титруя 0,1 н раствором AgNO3. Определять аналогично измерению обменной емкости катионита.
Работа 16. «Разделение компонентов раствора красителей бумажной хроматографией»
Задание.1. Разделить компоненты чернил методом восходящей хроматографии. 2. Рассчитать Rf компонентов.
Выполнение работы.Приготовить по 50 – 100 мл н-бутанола, этанола и 2 н раствора аммиака в соотношениях 3 : 1 : 1 (по объему). Раствор налить на дно широкой склянки Нарезать квадратные листы бумаги (ватман № 1) с длиной стороны 20см. Бумагу положить на чистый лист писчей бумаги того же формата на столе. Параллельно одной стороне бумаги на расстоянии 3 см от края провести графитовым карандашом горизонтальную линию (стартовая линия). На расстоянии 2 см от края линии нанести 3 метки вдоль нее на расстоянии 3 см друг от друга. Смешать в любых соотношениях, например, красные и синие чернила. Нанести из тонкого стеклянного капилляра по маленькой капле чернильной смеси и отдельно по капле синих и красных чернил на отмеченные точки. Высушить бумагу. Слабо свернуть ее в цилиндр и закрепить верх и низ цилиндра скрепками для бумаги. Уровень растворителя должен быть на 1 – 1,5 см ниже стартовой линии. Сосуд закрыть крышкой. Разделение закончить когда фронт растворителя поднимается на 10–12 см выше стартовой линии (около 1 ч). Бумагу вынуть, отметить карандашом фронт растворителя и высушить. Определить Rf пятен для свидетелей и смеси (см. рисунок 4).
Работа 17 «Разделение катионов бумажной хроматографией»
Задания. 1. Разделить смесь катионов Fe2+, Co2+, Ni2+ и Mn2+ горизонтальным методом. 2. Сравнить Rf индивидуальных веществ и сопоставить с Rf в смеси.
Выполнение работы. Приготовить 0,1 М растворы солей Fe2+, Co2+, Ni2+ и Mn2+ и раствор их смеси так, чтобы концентрация каждой соли в нем была бы тоже 0,1 моль/л. Приготовить 100 мл растворителя из ацетона, воды и концентрированной НCl в соотношении 7 : 5 : 8 (по объему). Вырезать кружок бумаги (ватман № 1) диаметром 15 см. Провести две параллельные линии от периферии к центру бумаги по радиусу на расстоянии 0,5 см друг от друга. Вырезать полоску бумаги и отогнуть ее (фитиль). На расстоянии 1,5 см от центра бумаги нанести карандашом кружок (стартовая линия). Сделать на нем пять меток карандашом и пронумеровать их. При помощи тонкого стеклянного капилляра нанести на метки по 0,04 мл каждого раствора (включая и смесь). Высушить бумагу. Затем 25 мл растворителя в стакане на подставке внести в небольшой эксикатор. Меченую бумагу поместить на кромку эксикатора. Опустить бумажный фильтр в растворитель и плотно закрыть эксикатор. Капиллярными силами растворитель поднимается вверх по фитилю и бумаге. Скорость процесса зависит от ширины фитиля и расстояния между поверхностями жидкости и бумаги. После перемещения фронта растворителя на 3 – 4 см от стартовой линии бумагу вынуть и высушить. Для проявления пятен бумагу выдержать некоторое время в парах концентрированного раствора аммиака, затем опустить в аммиачный раствор диметилглиоксима (1 % -ный раствор диметилглиоксима + 2 н NH4OH, 1:1). Отметить цвет каждого пятна и его Rf работу можно проводить также в кристаллизаторе, закрывая его сверху стеклом, или в чашечке Петри, на дно которой налить растворитель.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Как влияет на адсорбцию природа адсорбента, адсорбтива и растворителя?
2. Как рассчитать коэффициенты k и n в уравнении Фрейндлиха – Бедекера?
3. Что такое ионообменная адсорбция? Указать принципы использования различных видов адсорбционной, ионообменной и распределительной хроматографии.
4. Указать методы определения обменной емкости ионита.
ЗАДАЧИ
1. Определить графически константы k и n в уравнении Фрейндлиха – Бедекера, из следующих данных
| с, ммоль/мл | ||||
| х|m, ммолъ/г | 0,746 | 0,624 | 0,801 | 1,110 |
2. Поверхность 1 г активного древесного угля 1000 м2. Сколько литров аммиака при 25 °С и 1 атм может адсорбироваться на поверхности 45 г угля, если вся поверхность полностью покрыта. Диаметр молекулы NH3 3 . 10–8 см. Ответ: 18,6.
3. MgO адсорбирует SiO2 из воды. Определить графически константы в уравнении Фрейндлиха по данным:
| MgO частей на 1 млн | ||||
| Остаток SiO2, частей на 1 млн | 26,2 | 9,2 | 6,2 | 1,0 |
| SiO2 (удаленный), частей на 1 млн | 20,0 | 25,2 |
и рассчитать количество MgO, необходимое, чтобы уменьшить остаток SiO2 до 2,9 ч на 1 млн.
4. Через колонку с 5 г катионита пропустили 500 мл 0,05 н раствора соли кальция. При определении иона Са2+ в элюате в порциях по 50 мл получили следующие его концентрации (в г-экв/л): 0,003; 0,008; 00,015; 0,025; 0,04; 0,05. Определить динамическую емкость катионита по Са2+. Ответ: 0,323 г.
5. Сколько граммов никеля останется в растворе, если через колонку с 10 г катионита пропустить 500 мл 0,05 н. Раствора соли никеля. Полная динамическая емкость в этих условиях 1,4 мг-экв/г.
Ответ: 0,323 г.
6. Определить графически константу k в уравнении Никольского, по следующим экспериментальным данным реакций обмена ионов Са2+ из почвы на ионы Nа+ из раствора его соли:
| Концентрация ионов в растворе (С . 103, кмоль/м3 ) | ||||||
| Na+ | 3,26 | 6,60 | 13,80 | 21,25 | 38,41 | 65,19 |
| Ca2+ | 37,84 | 36,72 | 34,62 | 31,87 | 26,16 | 17,10 |
| Количество сорбированных ионов (С . 105, кмоль/кг ) | ||||||
| Na+ | 0,28 | 0,60 | 1,20 | 1,89 | 3,18 | 7,62 |
| Ca2+ | 39,72 | 39,56 | 39,40 | 38,93 | 38,68 | 37,40 |
7. По данным ионного обмена ионов Ca2+ (xl, cl) и Na+ (x2, c2) на синтетическом ионите определить графически константу k в уравнении Никольского
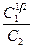 в растворе в растворе
| 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,8 |
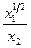 на сорбенте на сорбенте
| 0,75 | 1,0 | 1,5 | 1,8 | 2,4 | 3,1 |
3 Лабораторные работы и задачи, предлагаемые [12]
Дата добавления: 2020-07-18; просмотров: 874;











