ЛАБОРАТОРНЫЕ РАБОТЫ
Работа 18 «Изучение адсорбции ПАВ из растворов на твердом адсорбенте»
Цель работы: получение изотерм поверхностного натяжения растворов ПАВ на границе с воздухом; определение предельной адсорбции ПАВ из водного раствора на угле; вычисление удельной поверхности адсорбента.
Краткая теория.Типичные ПАВ имеют асимметрично построенные молекулы, состоящие из двух частей: активной полярной группы, хорошо взаимодействующей с молекулами воды, типа –ОН, –СООН, –NH2, –NO2, –SO3H, –SO3Na, –COONa и др., и неполярной гидрофобной группы – углеводородного радикала.
Такие дифильные молекулы, способные взаимодействовать одновременно с полярными и неполярными средами, самопроизвольно накапливаются на границах раздела фаз, понижая энергию Гиббса поверхности и образуя адсорбционный слой определенной структуры. В адсорбционных слоях молекулы ПАВ ориентируются полярными группами в сторону полярной среды (воды), а гидрофобной неполярной частью – в сторону менее полярной фазы (воздуха, углеводородной жидкости). По мере заполнения поверхности раздела вода – воздух молекулами ПАВ поверхностное натяжение на этой границе резко снижается. В разреженных адсорбционных слоях молекулы ПАВ располагаются вдоль поверхности. Такое расположение ПАВ приводит к наибольшему экранированию молекул воды и обеспечиваетминимальное поверхностное натяжение раствора.
С ростом концентрации раствора число молекул ПАВ в адсорбционном слое увеличивается. При некоторой концентрации раствора может образоваться предельно насыщенный адсорбционный слой, так называемый «частокол Ленгмюра». В этом случае поверхностный слой отвечает конденсированной пленке и поверхность воды оказывается сплошь покрытой углеводородными участками молекул ПАВ. Поверхностное натяжение растворов при этих концентрациях приближается к значению поверхностного натяжения самих поверхностно-активных веществ на границе с воздухом.
При введении адсорбентов в водные растворы ПАВ молекулы ПАВ адсорбируются на границе вода–твердая поверхность. Согласно правилу Ребиндера при адсорбции ПАВ разность полярностей между адсорбентом и растворителем уменьшается. Все полярные гидрофильные поверхности адсорбируют ПАВ из неполярных и слабополярных жидкостей. Неполярные сорбенты, такие, как уголь или некоторые полимерные материалы, наоборот, хорошо адсорбируют ПАВ из полярных жидкостей.
На адсорбцию ПАВ из растворов существенное влияние оказывает и пористость сорбента. Влияние пористости определяется соотношением размеров пор и молекул ПАВ. С уменьшением размеров пор адсорбция небольших молекул ПАВ, как правило, возрастает. Однако это наблюдается, только если молекулы ПАВ имеют размеры, позволяющие проникнуть в поры адсорбента.
По истечении определенного времени в системе адсорбент–водный раствор ПАВ устанавливается равновесие между количеством А молекул ПАВ, перешедших на поверхность сорбента, и их объемной равновесной концентрацией с. Это равновесие может быть описано уравнением Ленгмюра (3.2), при этом емкость монослоя A¥ отвечает предельной адсорбции. Для более точного определения величины A¥, предпочтительнее использовать уравнение Ленгмюрав линейной форме:
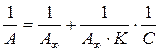 (3.16)
(3.16)
Графически зависимость 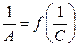 выражается прямой, пересекающей ось ординат. Отрезок, отсекаемый от оси ординат, определяет величину, обратную емкости монослоя. Тангенс угла наклона прямой позволяет найти константу адсорбционного равновесия K.
выражается прямой, пересекающей ось ординат. Отрезок, отсекаемый от оси ординат, определяет величину, обратную емкости монослоя. Тангенс угла наклона прямой позволяет найти константу адсорбционного равновесия K.
Величину адсорбции А для ПАВ обычно рассчитывают, определяя концентрацию раствора до и после адсорбции:
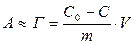 , (3.17)
, (3.17)
где С0, с – начальная и равновесная концентрации ПАВ в растворе;
m – масса адсорбента;
V – объем раствора ПАВ, в который введен адсорбент.
Разность концентраций поверхностно-активного вещества С0–с удобно определять по изменению поверхностного натяжения раствора.
Определив экспериментально емкость монослоя A¥по формуле (3.4), можно рассчитать удельную поверхность адсорбента Sуд, т. е. поверхность, приходящуюся на единицу массы адсорбента. Для этого необходимо знать площадь s0, занимаемую одной молекулой адсорбата в насыщенном адсорбционном слое на границе раздела фаз. Согласно исследованиям Ленгмюра и Гаркинса площадь, занимаемая одной молекулой большинства одноосновных жирных кислот и спиртов, составляет 0,2–0,3 нм2.
Дата добавления: 2020-07-18; просмотров: 780;











