МОЛЕКУЛЯРНАЯ АДСОРБЦИЯ
Адсорбция неэлектролитов и слабых электролитов на границе раздела т-ж носит молекулярный характер и подчиняется уравнению Гиббса. Если растворенное вещество (адсорбтив) адсорбируется в большем количестве, чем растворитель, то адсорбция его положительна. При большей адсорбции растворителя адсорбция отрицательна. Поэтому изотерма адсорбции из растворов кажущаяся.
Для адсорбции из растворов установлен ряд закономерностей. Адсорбция органических веществ одного и того же гомологического ряда подчиняется правилу Траубе. На пористых адсорбентах наблюдается обращение привила Траубе; адсорбция падает с ростом длины цепи, так как с возрастанием размера молекул уменьшается доступная для адсорбции площадь адсорбента; крупные молекулы не могут попасть в узкие поры адсорбента. При адсорбции на границе т-ж по правилу уравнивания полярностей, сформулированному Ребиндером, вещество адсорбируется на границе раздела фаз только в том случае, если в результате его присутствия в поверхностном слое разность полярностей фаз уравнивается.
Для измерения адсорбции в одинаковые объемы растворов адсорбируемого вещества разной концентрации вносят точную навеску адсорбента. Затем определяют равновесную концентрацию после адсорбции. Количество адсорбированного вещества вычисляют как разность начальной и равновесной концентрации в данном объеме раствора. В разбавленных растворах адсорбцию растворителя обычно не учитывают.
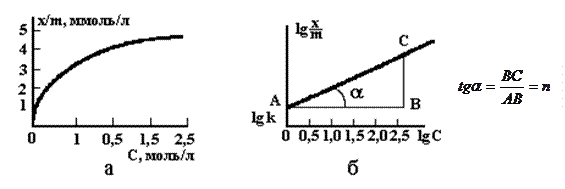 |
Рисунок 1 – Изотерма абсорбции на границе раздела т-ж (а) и графическое определение констант в уравнении Фрейндлиха – Бедекера (б)
По экспериментальным данным строят кривую – изотерму адсорбции, выражающую зависимость массы адсорбированного вещества от равновесной концентрации его в растворе. Массу адсорбированного вещества относят не к единице поверхности, а к единице массы адсорбента (рисунок 1). Вид изотермы, получаемой при образовании мономолекулярного слоя на непористых адсорбентах, хорошо соответствует уравнению Лэнгмюра. Адсорбция на пористых адсорбентах из разбавленных растворов описывается эмпирическим уравнением, предложенным Бедекером и Фрейндлихом:
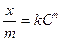 ,
,
где 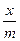 – масса адсорбированного вещества на единицу массы адсорбента ммолъ/г; с – равновесная концентрация, ммолъ/л; k – константа, соответствующая массе адсорбированного вещества при равновесной концентрации, равной единице; n – константа (n = 0,1 – 0,5).
– масса адсорбированного вещества на единицу массы адсорбента ммолъ/г; с – равновесная концентрация, ммолъ/л; k – константа, соответствующая массе адсорбированного вещества при равновесной концентрации, равной единице; n – константа (n = 0,1 – 0,5).
Чтобы найти k и n, уравнение логарифмируют
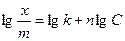
Наносятся значения 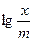 по оси ординат, a lgс – по оси абсцисс, получают прямую линию (рисунок 1, б). Отрезок ОА, отсекаемый прямой на ординате, дает значение lgk, а тангенс угла наклона прямой к оси абсцисс (tga) – n. Уравнение применимо для растворов адсорбтива средних концентраций.
по оси ординат, a lgс – по оси абсцисс, получают прямую линию (рисунок 1, б). Отрезок ОА, отсекаемый прямой на ординате, дает значение lgk, а тангенс угла наклона прямой к оси абсцисс (tga) – n. Уравнение применимо для растворов адсорбтива средних концентраций.
Адсорбция ионов
Адсорбенты делят на гомеополярные и гетерополярные. Первые очень слабо адсорбируют электролиты, у вторых происходит обмен ионами с раствором, и которые называются ионитами. На границе раздела твердой фазы с водными растворами возникает двойной электрический слой в результате диссоциации ионогенных групп, находящихся на поверхности твердой фазы, или избирательной адсорбции одного из ионов из раствора. Ионы внешней обкладки – протавоионы, – не входящие в состав твердой фазы, связаны с ней электростатическими силами и находятся в динамическом равновесии с ионами раствора. Они обмениваются в эквивалентном количестве на ионы того же знака в растворе, и такая адсорбция называется ионообменной.
В зависимости от знака противоиона, вступающего в обмен, различают катионы, аниониты – анионы. Наибольшее значение имеют органические иониты из синтетических ионообменных смол, образующие структуру пространственной сетки. Сетка полимера, заполненная раствором, является как бы одной гомогенной фазой, в узлах которой закреплены ионы одного знака. Противоионы находятся в растворе внутри сетки и способны обмениваться. Активные группы у катионообменных смол – SO3H, –СООH, –ОH, –РО3H2 и др.
Анионообменные смолы содержат аминогруппы. В общем виде ионный обмен на границе ионит – раствор можно выразить уравнением
АМ1 + М2 Û АМ2 + М1
где А – ионит; М1 и М2 – обменивающиеся ионы.
Количественная зависимость для обмена ионов с зарядами n1 и n2 определяется по уравнению Никольского:
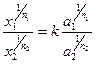
где х1 и х2 – масса адсорбированных ионов при равновесии; а1 и а2 – активности (или концентрации) этих ионов в равновесном растворе; k – константа обмена.
Обменная способность ионита к одному из ионов зависит от соотношения активностей пары ионов, участвующих в обмене.
Основная характеристика ионита – количество поглощаемых им ионов – называется обменной емкостью или обменной способностью. Она зависит от числа активных групп на единицу массы или объема ионита и от степени диссоциации этих групп. Обменную емкость можно определить в статистических и динамических условиях.
Статическая обменная емкость соответствует ионообменному равновесию, которое устанавливается между ионитом и данной концентрацией электролита. Динамическая обменная емкость характеризуется динамической емкостью до проскока и полной динамической обменной емкостью (до полного извлечения данного иона из раствора).
Для определения ионообменной емкости сильнокислотные и сильноосновные иониты применяют в рН+ и ОН– – форме. Иониты, обычно в виде Na-солей и хлоридов, требуют предварительной очистки от возможных загрязнений. Зерна ионита промывают раствором НС1 (1:1) в специальных колонках до удаления ионов железа (Fe3+) затем водой до нейтральной среды и отсутствия ионов Сl– (проба с AgNO3). Очищенный ионит в той же колонке переводят в H+ – форму (для катеонитов) или в OH– – форму (для анионитов). Для перевода в H+ – форму катионит промывают 5 – 6 % раствором НС1 до тех пор, пока не прекратится изменение кислотности фильтра, а потом – дистиллированной водой.
Анионит в OH– – форме получают, промывая 2 %-ным раствором основания до прекращения изменения его концентрации в фильтрате по сравнению с исходным раствором.
Характеристикой ионита в динамических условиях являются выходные кривые, показывающие зависимость концентрации иона в фильтрате от объема раствора, прошедшего через колонку. Раствор пропускают через колонку с постоянной скоростью.
|
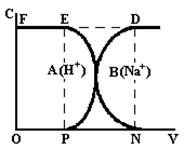
Рисунок 2 – Выходные кривые обмена Na+ на Н+
Отбирают равные объемы фильтрата и определяют в них концентрацию ионов. На рисунке 2 показаны выходные кривые обмена ионов Na+ на Н+– ионы. Проскок иона Н+, т. е. появление его в фильтрате, происходит в точке Р. Затем кривая поднимается вверх. Полное вытеснение ионов Н+ наступает в точке D, где их концентрация дальше не изменяется. Динамическая емкость до проскока определяется площадью OPEF, а полная обменная емкость – площадью OPDF. Обменную емкость выражают в мг-экв/г сухого ионита.
|
Рисунок 3 – Хроматографическая колонка
ХРОМАТОГРАФИЯ
Хроматография–физико–химический метод разделения сложных смесей, при котором компоненты распределяются по разному между двумя фазами. Одна фаза неподвижная с большой поверхностью контакта, другая подвижная в виде потока, фильтрующегося через неподвижный слой. Неподвижная фаза оформляется в виде колонки или тонкого слоя. Через них протекает подвижная фаза. Разделяемые вещества в начале растворены в подвижной фазе. Они интенсивно взаимодействуют с неподвижной фазой, ассоциируясь с ней, а поэтому только медленно перемещаются в направлении фронта растворителя. Вещества, слабо взаимодействующие с неподвижной фазой, вымываются быстрее. Разделяются вещества в соответствии с их различной скоростью передвижения в колонке или в тонком слое.
По природе взаимодействия разделяемых веществ с твердой фазой различают адсорбционную, распределительную и ионообменную хроматографии.
Адсорбционная хроматография основана на молекулярной адсорбции и подчиняется уравнению Лэнгмюра.
В основе распределительной хроматографии лежит различие в коэффициентах распределения разделяемых веществ между двумя жидкими фазами.
По методике проведения различают колоночную, хроматографию на бумаге и тонкослойную.
Сорбция, ионный обмен, распределение между фазами различного состава протекают непрерывно при последовательном многократном повторении. При колоночной хроматографии изучаемую смесь веществ в виде раствора (жидкая фаза) пропускают через колонку со слоем сорбента твердая (фаза). Отдельные растворенные вещества адсорбируются и образуют зоны адсорбции в виде первичной хромограммы. При промывании колонки растворителем разделяются зоны адсорбции (проявление хромограммы).
Выполнение работы.При распределительной хроматографии твердую фазу (носитель) пропитывают одним из растворителей, и его рассматривают как неподвижный. Другой растворитель, менее полярный, пропускают через колонку, заполненную носителем. Это подвижный растворитель.
В бумажной хроматографии носителем служит фильтровальная бумага. Фильтровальная бумага в качестве носителя имеет ряд преимуществ: меньшую адсорбционную способность, равномерность материала, листообразную форму, пригодную для двухмерной хроматографии; возможность разделения веществ в количествах очень малых (микро граммы). Неподвижной фазой служит воздушно сухая бумага, содержащая около 25 % воды. В качестве подвижной фазы применяют различные органические растворители и их смеси менее полярные, чем вода. Подвижная фаза должна передвигаться вдоль стационарной фазы.
Различают горизонтальный, восходящий и нисходящий методы.
Раствор исследуемой смеси веществ наносят в виде капли на конец бумажной плоскости. Бумагу высушивают. Конец ее ниже места нанесения капли опускают в ванную с растворителем. При медленном продвижении растворителя через поры бумаги вместе с ним перемещаются растворенные веществ а, и смесь непрерывно распределяется между двумя жидкими фазами – водой и растворителем. Разделение компонентов основано на различии их коэффициентов распределения.
|
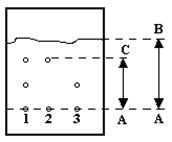
Рисунок 4 – Определение Rf при хроматографии на бумаге
и тонкослойной хроматографии:
АВ – расстояние от стартовой линии до фронта растворителя;
АС – расстояние от стартовой линии до центра пятна.
Хроматографирование на бумаге проводят в атмосфере насыщенных паров применяемых растворителей. После достаточного продвижения фронта растворителя на бумаге процесс заканчивают и бумагу высушивают. При разделении бесцветных веществ хроматограмму опрыскивают (проявляют) реактивом, образующим окрашенные соединения с анализируемыми веществами. При этом на хромограмме образуется ряд цветных пятен, расположенных в определенном порядке. Вещества характеризуются фактором удерживания Rf(рисунок 4). Он равен отношению расстояния АС, пройденного растворенным веществом на бумаге, к расстоянию АВ, пройденному фронтом растворителя. В хроматографии на бумаге и тонкослойной хроматографии: фронтом растворителя. Для качественного анализа бумажных хроматограмм используют «способ свидетелей», нанося на одной и той же полосе бумаги пятно смеси исследуемых веществ и отдельно пятна набора веществ, присутствие которых в смеси предполагается. После проявления хроматограммы сопоставляют положение пятен «свидетелей» с положением пятен неизвестных веществ.
В методе тонкослойной хроматографии в качестве носителя для распределения жидкостной хроматографии вместо бумаги используют тонкий слой сорбента, нанесенный на небольшую стеклянную пластинку. В качестве сорбентов применяют окись алюминия марки «для хроматографии», силикагель, гипс, кизельгур, целлюлозу. В тонкослойной хроматографии используют растворители, обладающие разной полярностью в разных соотношениях.
При работе с незакрепленным слоем сорбент насыпают на стеклянную пластинку (можно использовать фотопластинки 9´12 см) и разравнивают стеклянной палочкой. Для сорбента с закрепленным слоем готовят массу из 50 г окиси алюминия (или силикагеля) с добавкой закрепителя, 0,2 г сульфата кальция и 412 мл воды. Смесь размешивают до получения однородной массы. Часть ее наносят на стекло и разравнивают легким покачиванием. Пластинку с нанесенным слоем сначала сушат на воздухе, затем активируют слой нагреванием в сушильном шкафу при 120 °С в течение 1 ч. Готовые пластинки хранят в эксикаторе.
Дата добавления: 2020-07-18; просмотров: 776;