Адсорбция на гидроксидах и других материалах
Адсорбция ионов на коллоидных и аморфных осадках, в том числе и на гидроксидах многовалентных металлов, отличается некоторыми особенностями от адсорбции на кристаллах. Важнейшим отличительным признаком является непостоянство свойств поверхности таких адсорбентов. Для гидроксидов характерны три вида адсорбции: ионообменная, молекулярная и хемосорбция. Наиболее хорошо изучена адсорбция ионов на Fе(ОН)3 и А1(ОН)3. На примере Се и К и показано, что гидроокиси Fе и А1 могут адсорбировать катионы путем первичной ионообменной адсорбции в потенциалобразующей обкладке, имеющей положительный заряд за счет катионов Fе3+ или А13+. Кроме первичной адсорбции на гидроокисях, наблюдается и вторичная ионообменная адсорбция ионов, закономерности которой в общих чертах совпадают с закономерностями вторичной адсорбции на полярных кристаллах.
Коллоидные и аморфные тела проявляют и специфический вид обменной адсорбции, заключающийся в том, что при образовании адсорбенты могут удерживать часть электролита. Этот электролит при определенных условиях вступает в обменные реакции, причем степень адсорбции тем больше, чем меньше очистка адсорбента от электролита. Такая адсорбция имеет место даже в весьма концентрированных растворах, когда толщина двойного электрического слоя мала.
Хемосорбция наблюдается в том случае, если адсорбируемый ион образует на поверхности гидроокиси прочное химическое соединение. Молекулярная адсорбция была замечена при изучении адсорбции серебра на полуторных окислах.
Адсорбция на угле. Адсорбция радиоактивных элементов на угле изучалась одновременно с адсорбцией стабильных изотопов. Было показано, что механизм адсорбции зависит от физико-химических свойств поверхности угля. В качестве адсорбентов могут использоваться зольные, обеззольные и окисленные угли. Различают адсорбцию молекулярную, ионообменную, гидролитическую и другие типы.
Адсорбция радиоактивных элементов на стекле и бумаге. Важное практическое значение имеет адсорбция радиоактивных элементов на стекле и бумаге, из-за которой часто экспериментальные данные получаются ошибочными. Примером служат многочисленные исследования по определению растворимости сульфата радия. Для устранения вредного влияния адсорбции применяют удерживающие носители, которые препятствуют соосаждению. Например, полоний из разбавленных растворов в большой степени адсорбируется на стеклянной поверхности. Добавление к полонию теллура—-антиносителя — снижает процент адсорбции. Поэтому при работе с изотопами всегда следует учитывать адсорбционные свойства стекла и фильтрованной бумаги. Но следует заметить, что имеющиеся работы по этому вопросу не дают достаточно полного представления о механизме адсорбции.
Статика сорбции
Теория межфазного распределения состоит из тех разделов: статики кинетики и динамики этого процесса.
Статика исследует термодинамически равновесное состояние сорбционных систем, т.е. фиксируется равновесное распределение вещества между двумя фазами строго определенной массы и или объема при заданных концентрации и температуре.
Практически процесс сорбции в статических условиях проводят в сосуде с определенны объемом раствора, содержащим сорбат или смесь сорбатов с известной концентрацией. В сосуд вносят навеску сорбента, полученную суспензию выдерживают до состояния равновесия при перемешивании. О наступлении равновесия судят по результатам измерения во времени содержания радионуклида в растворе или в фазе сорбента. При это следует иметь в виду, различают эмпирическое и термодинамическое равновесие. В первом случае критерием равновесия является практически не изменяемый во времени параметр процесса (удельная активность, концентрация, масса). О термодинамическом равновесии свидетельствует минимум свободной энергии. Как правило, эмпирического равновесия бывает вполне достаточно.
Итак, необходимо определить состояние системы в начальный момент (до контакта фаз) и после установления эмпирического равновесия. Введем некоторые обозначения.
M0- количество ядер радионуклида в исходном растворе; содержание радионуклида в фазе сорбента в начальный момент времени 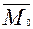 = 0. Исходная концентрация радионуклида в растворе С0= M0/V, где V - объем раствора.
= 0. Исходная концентрация радионуклида в растворе С0= M0/V, где V - объем раствора.
После внесения в раствор сорбента начинается переход радионуклида их раствора в твердую фазу. При t=tp в системе наступает равновесное состояние , которое характеризуется равновесными параметрами: 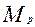 и
и 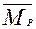 - равновесные количества радионуклида соответственно в растворе и твердой фазе , причем
- равновесные количества радионуклида соответственно в растворе и твердой фазе , причем 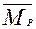 =
= 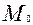 -
- 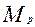 .
.
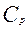 =
= 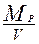 - равновесная концентрация радионуклида в растворе;
- равновесная концентрация радионуклида в растворе; 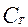 =
= 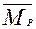 /
/ 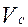
 - равновесная концентрация радионуклида в фазе сорбента.
- равновесная концентрация радионуклида в фазе сорбента.
Исходные и равновесные параметры используют для расчета характеристик сорбционной системы.
Степень сорбции: S= 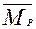 /
/ 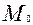 = (
= ( 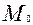 -
- 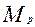 ) /
) / 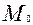 . Видно, что степень сорбции безразмерная величина, которая определяется непосредственно из опыта:
. Видно, что степень сорбции безразмерная величина, которая определяется непосредственно из опыта: 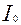 = k∙
= k∙ 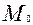 и
и 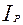 = k∙
= k∙ 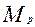 . где
. где 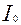 и
и 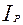 - исходная и равновесная уделные скорости счета раствора до и после сорбции соответственно.
- исходная и равновесная уделные скорости счета раствора до и после сорбции соответственно.
Распределительное отношение – ε = 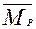 /
/ 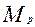 =
= 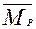 / (
/ ( 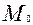 -
- 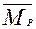 ) = S/ 1-S
) = S/ 1-S
Коэффициент распределения 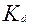 =
= 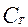 /
/ 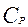 -устанавливает соотношение между равновесными концентрациями радионуклида в сорбенте и растворе. В общем случае
-устанавливает соотношение между равновесными концентрациями радионуклида в сорбенте и растворе. В общем случае 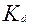 -безразмерная величина.
-безразмерная величина.
В сорбционной практике коэффициент распределения часто рассчитывают иначе:
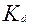 =
= 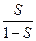 ∙
∙ 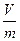 , гдеV – объем раствора, мл; m- масса сорбента, г. В этом случае
, гдеV – объем раствора, мл; m- масса сорбента, г. В этом случае 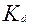 имеет размерность мл/г.
имеет размерность мл/г.
Коэффициент концентрирования - 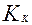 =
= 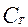 /
/ 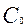 -показывает, во сколько раз изменилась концентрация радионуклида при переходе из раствора в сорбент.
-показывает, во сколько раз изменилась концентрация радионуклида при переходе из раствора в сорбент.
Коэффициент очистки- 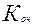 =
= 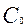 /
/ 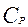 ,показывает, во сколько раз уменьшилась концентрация радионуклида в растворе после сорбции. Видим, что
,показывает, во сколько раз уменьшилась концентрация радионуклида в растворе после сорбции. Видим, что 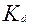 =
= 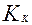 ∙
∙ 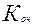 .
.
Коэффициент разделения - 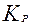 (x,y) =
(x,y) = 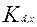 /
/ 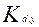 .
.
Следует отметить, что наиболее фундаментальной характеристикой межфазного распределения является коэффициент распределения. Зная его величину, можно рассчитать все прочие важные в технологическом отношении характеристики при заданном удельном содержании сорбента в системе. По своему физико-химическому смыслу 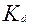 характеризует меру специфичности (сродства) поглотителя к данному радионуклиду, а
характеризует меру специфичности (сродства) поглотителя к данному радионуклиду, а 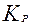 ( x,y) характеризует меру селективности (избирательности) поглотителя.
( x,y) характеризует меру селективности (избирательности) поглотителя.
Итак, при анализе закономерностей статики межфазного распределения достаточно установить, какие факторы и каким образом влияют на величину коэффициента распределения. Это анализ необходим как для выбора оптимальных условий концентрирования, выделения и разделения радионуклидов с использованием методов межфазного распределения. Так и для выяснения вопроса о физико-химических особенностях поведения радионуклидов – микрокомпонентов в гетерогенных системах.
В общем случае на величину коэффициента распределения влияют следующие факторы:
Концентрация сорбата, концентрация фонового электролита, рН, удельная масса сорбента, температура и др.
Дата добавления: 2021-10-28; просмотров: 780;











