Аналитические выражения
для теплоемкостей сυи ср
Как указывалось, теплоемкости зависят от характера процесса.
В термодинамике имеют большое значение теплоемкость при постоянном объеме
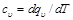 , (5.4)
, (5.4)
равная отношению количества теплоты dqv в процессе при постоянном объеме к изменению температуры dT тела, и теплоемкость при постоянном давлении
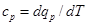 , (5.5)
, (5.5)
равная отношению количества теплоты dqp в процессе при постоянном давлении к изменению температуры dT тела.
Из уравнения (5.4) следует, что в процессе при υ=const, в котором тело не совершает внешней работы, вся теплота, сообщаемая телу, идет на изменение его внутренней энергии:
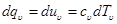 , (5.6)
, (5.6)
или при cυ =const
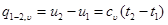 .
.
Изменение внутренней энергии идеального газа равно произведению теплоемкости сv при постоянном объеме на разность температур тела в любом процессе.
Дифференцируя уравнение I закона термодинамики по температуре при p=const и применяя уравнение Клайперона, получим для идеального газа:
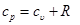 и
и 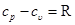 . (5.7)
. (5.7)
Это уравнение носит название уравнения Майера. Оно может быть записано и для 1 кмоль:
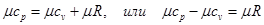 (5.8)
(5.8)
Следовательно, для идеальных газов разность между μср и μсυ есть
величина постоянная.
Для приближенных расчетов при не очень высоких температурах можно рекомендовать использование постоянных мольных теплоемкостей μСυ и μCр, полученных с некоторой корректировкой для трех- и многоатомных газов на основании молекулярно-кинетической теории теплоемкости. Эти данные приведены в табл. 5.1. Точные значения теплоемкостей идеальных газов в зависимости температуры приводятся в специальных таблицах.
Таблица 5.1.
| Атомность газа | Мольная теплоёмкость, кДж/кмоль·К | |
| μСυ | μСp | |
| Одноатомный | 12,5 | 20,8 |
| Двухатомный | 20,8 | 29,1 |
| Трехатомный | 29,1 | 37,4 |
Дата добавления: 2020-07-18; просмотров: 763;











