Аналитическое выражение первого закона термодинамики
Пусть 1 кг рабочего тела совершает некоторый процесс (рис. 4.2), на элементарном участке которого 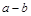 подводится бесконечно малое количество энергии в форме теплоты
подводится бесконечно малое количество энергии в форме теплоты 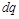 ; при этом температура и объем тела увеличиваются соответственно на бесконечно малые величины
; при этом температура и объем тела увеличиваются соответственно на бесконечно малые величины 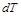 и
и 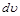 .
.
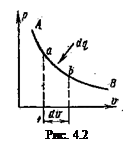 С повышением температуры тела на
С повышением температуры тела на 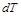 увеличивается скорость молекул или увеличивается его внутренняя кинетическая энергия.
увеличивается скорость молекул или увеличивается его внутренняя кинетическая энергия.
С увеличением объема на 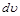 тело совершает внешнюю работу по преодолению внешних сил, которую обозначают
тело совершает внешнюю работу по преодолению внешних сил, которую обозначают 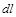 .
.
Согласно закону сохранения энергии, можно написать для данного процесса следующее уравнение:
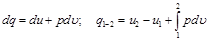 . (4.6)
. (4.6)
Полученное уравнение является математическим выражением первого закона термодинамики. Оно формулируется так: изменение внутренней энергии термодинамической системы равно алгебраической сумме полученной системой энергии в форме теплоты dl и совершенной ею внешней работой 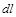 , или подведенная к рабочему телу энергия в форме теплоты расходуется на изменение внутренней энергии тела и на совершение телом внешней работы.
, или подведенная к рабочему телу энергия в форме теплоты расходуется на изменение внутренней энергии тела и на совершение телом внешней работы.
Все величины, входящие в уравнение (4.6), могут быть как положительными, так и отрицательными и в некоторых случаях могут принимать нулевые значения.
Энтальпия
В позапрошлом столетии известный физик Томас Гиббс ввел в практику тепловых расчетов новую функцию, которую назвал энтальпией. Удельная энтальпия, т. е. энтальпия, отнесенная к 1 кг, обозначается буквой 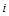 и измеряется в килоджоулях на килограмм (кДж/кг); она представляет собой, по определению, сложную функцию вида
и измеряется в килоджоулях на килограмм (кДж/кг); она представляет собой, по определению, сложную функцию вида
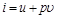 . (4.7)
. (4.7)
Поскольку входящие в энтальпию величины 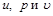 являются параметрами (функциями) состояния, следовательно, и сама энтальпия будет также параметром (функцией) состояния.
являются параметрами (функциями) состояния, следовательно, и сама энтальпия будет также параметром (функцией) состояния.
Энтальпия идеального газа так же, как и внутренняя энергия, является функцией только температуры и не зависит от других параметров.
Если в качестве независимых параметров выбрать давление 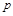 и температуру
и температуру 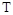 , то можно получить другой вид аналитического выражения первого закона термодинамики:
, то можно получить другой вид аналитического выражения первого закона термодинамики:
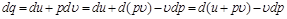 .
.
Отсюда
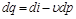 , (4.8)
, (4.8)
или
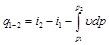 . (4.9)
. (4.9)
Интеграл 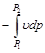 представляет собой чисто математическую величину и приобретает конкретное физическое содержание лишь при рассмотрении процессов истечения рабочего тела (см. разд. 10).
представляет собой чисто математическую величину и приобретает конкретное физическое содержание лишь при рассмотрении процессов истечения рабочего тела (см. разд. 10).
При 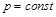 уравнение (4.8) превращается в
уравнение (4.8) превращается в
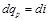 . (4.10)
. (4.10)
Дифференциал энтальпии 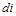 есть элементарное количество теплоты, участвующее в процессе при постоянном давлении. Вся теплота в процессе при постоянном давлении расходуется на изменение энтальпии:
есть элементарное количество теплоты, участвующее в процессе при постоянном давлении. Вся теплота в процессе при постоянном давлении расходуется на изменение энтальпии:
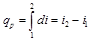 , (4.11)
, (4.11)
т.е энтальпия – “теплосодержание”.
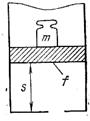
Рис. 4.3
Физический смысл энтальпии будет понятен из рассмотрения следующего примера. На перемещающийся поршень в цилиндре с 1 кг газа помещена гиря массой 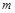 кг (рис. 4.3). Площадь поршня
кг (рис. 4.3). Площадь поршня 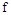 , внутренняя энергия рабочего тела
, внутренняя энергия рабочего тела 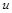 . Потенциальная энергия гири равна произведению массы гири
. Потенциальная энергия гири равна произведению массы гири 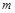 на высоту
на высоту 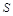 . Так как давление газа
. Так как давление газа 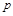 уравновешивается массой гири, то потенциальную энергию ее можно выразить так:
уравновешивается массой гири, то потенциальную энергию ее можно выразить так:
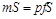 .
.
Произведение 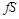 есть удельный объем газа. Отсюда
есть удельный объем газа. Отсюда
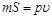 .
.
Произведение давления на объем есть работа, которую надо затратить, чтобы ввести газ объемом 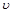 во внешнюю среду с давлением
во внешнюю среду с давлением 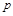 . Таким образом, работа
. Таким образом, работа 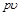 есть потенциальная энергия газа, зависящая от сил, действующих на поршень. Чем больше эти внешние силы, тем больше давление
есть потенциальная энергия газа, зависящая от сил, действующих на поршень. Чем больше эти внешние силы, тем больше давление 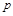 и тем больше потенциальная энергия давления
и тем больше потенциальная энергия давления 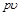 .
.
Если рассматривать газ, находящийся в цилиндре, и поршень с грузом как одну систему, которую будем называть расширенной системой, то полная энергия 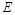 этой системы складывается из внутренней энергии газа u и потенциальной энергии поршня с грузом, равной
этой системы складывается из внутренней энергии газа u и потенциальной энергии поршня с грузом, равной 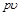 :
:
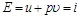 . (4.12)
. (4.12)
Отсюда видно, что энтальпия 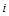 равна энергии расширенной системы – тела и окружающей среды. В этом и заключается физический смысл энтальпии.
равна энергии расширенной системы – тела и окружающей среды. В этом и заключается физический смысл энтальпии.
Значения энтальпии для паров, газов, газовых смесей приводятся в технической и справочной литературе.
При t0=0°C величину энтальпии i0 принимают равной нулю.
Энтальпия имеет большое значение и применение при расчётах тепловых машин, холодильных и калориферных установок и позволяет значительно упростить тепловые расчёты. Она позволяет применять графические методы при исследовании различных термодинамических поцессов и циклов (например is – и id – диаграммы для водяного пара и влажного воздуха).
Дата добавления: 2020-07-18; просмотров: 975;











