Основные определения
Первый закон термодинамики устанавливает взаимосвязь между количеством теплоты, изменением внутренней энергии и внешней работой газа, причем количество теплоты, подводимое к телу или отводимое от него, зависит от характера процесса.
К основным процессам, имеющим большое значение, как для теоретических исследований, так и для практических работ в технике, относятся: изохорный, протекающий при постоянном объеме; изобарный, протекающий при постоянном давлении; изотермный, протекающий при постоянной температуре; адиабатный, протекающий при отсутствии теплообмена с внешней средой.
Кроме того, существует группа процессов, являющихся при определенных условиях обобщающими для основных процессов. Эти процессы называются политропными и характеризуются постоянством теплоемкости в процессе.
Изохорный процесс
Процесс, протекающий при постоянном объеме, называют изохорным (dυ = 0, или υ = const ). Кривая процесса называется изохорой. На рис. 6.1 представлен график процесса.
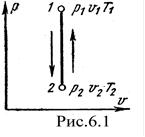 Согласно закону Шарля, при постоянном объеме давление газа изменяется прямо пропорционально абсолютным температурам:
Согласно закону Шарля, при постоянном объеме давление газа изменяется прямо пропорционально абсолютным температурам:
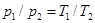 . (6.1)
. (6.1)
Внешняя работа газа при υ=const равна нулю, так как dυ = 0, т.е. l=0.
Основное уравнение первого закона термодинамики (4.6) при dl = 0 принимает вид
dqυ = duυ = cυdt.
Количество теплоты, участвующее в процессе при постоянной теплоемкости, равно
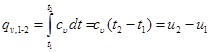 . (6.2)
. (6.2)
Вся внешняя теплота расходуется только на изменение внутренней энергии тела.
Если процесс 1-2, осуществляется с увеличением давления, теплота в нём подводится, при этом увеличивается внутренняя энергия и температура. Если давление газа в процессе понижается, то теплота отводится, уменьшается внутренняя энергия и температура (рис.6.1)
Изменение энтропии в изохорном процессе определяем из уравнения (5.21):
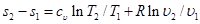 ,
,
но при υ=const ln υ2/υ1=0, поэтому изменение энтропии при постоянной теплоемкости равно
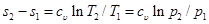 . (6.3)
. (6.3)
Как видно из данного уравнения, изохора на Тs-диаграмме представляет собой логарифмическую кривую.
Изобарный процесс
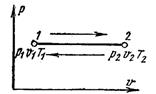
Рис. 6.2
Процесс, протекающий при постоянном давлении, называют изобарным (dр = 0, или р = const ). Кривая процесса называется изобарой. На рис. 6.2 изображен график процесса.
Из уравнения состояния идеального газа для изобарного процесса находим
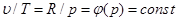
В соответствии с законом Гей-Люссака, в изобарном процессе объемы одного и того же количества газа изменяются прямо пропорционально абсолютным температурам:
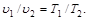 (6.4)
(6.4)
При расширении газа его температура возрастает, при сжатии — уменьшается.
Удельная работа изменения объема при этом выражается следующим уравнением:
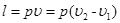 , (6.5)
, (6.5)
или
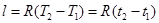 . (6.6)
. (6.6)
Основное уравнение первого закона термодинамики при р=const (dр=0) имеет вид
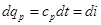 .
.
Следовательно, количество теплоты, сообщенное телу в изобарном процессе при постоянной теплоемкости, равно
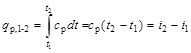 ; (6.7)
; (6.7)
при переменной теплоемкости
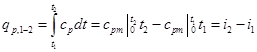 . (6.8)
. (6.8)
Для обратимого изобарного процесса при постоянной теплоемкости изменение энтропии находится по уравнению (5.23):
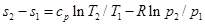 ,
,
но при р = const lnp2/p1=0, поэтому
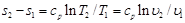 . (6.9)
. (6.9)
Изобара на Тs-диаграмме также, как и изохора, изображается логарифмической кривой.
Площадь под изобарой в некотором масштабе изображает количество теплоты qр, сообщаемое газу, равное изменению энтальпии i2-i1.
Из сопоставления уравнений (6.3) и (6.9) следует, что в случае осуществления изохорного и изобарного процессов в одном интервале температур возрастание энтропии будет больше в изобарном процессе, так как ср всегда больше сυ. Изобары являются более пологими кривыми, чем изохоры (см. рис. 6.3).
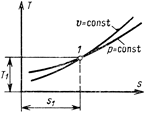
Рис. 6.3
Изотермный процесс
Процесс, протекающий при постоянной температуре, называют изотермным (Т = const, или dТ = 0). Кривая процесса называется изотермой (рис. 6.4).
Для изотермного процесса 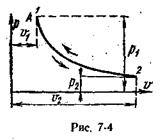 объем газа изменяется обратно пропорционально его давлению (закон Бойля — Мариотта):
объем газа изменяется обратно пропорционально его давлению (закон Бойля — Мариотта):
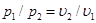 . (6.10)
. (6.10)
На рυ-диаграмме изотермный процесс представляет собой равнобокую гиперболу.
|
dq=dl и q1-2=l1-2.
Количество подведенной к идеальному газу теплоты численно равно работе изменения объема.
Зная уравнение изотермного процесса для идеального газа, и применяя уравнение состояния, определим удельную работу газа.
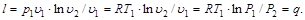 (6.11)
(6.11)
Энтальпия и внутренняя энергия идеального газа не меняются,
т. е. di =0 и du = 0.
Изотермный процесс на Ts-диаграмме изображается горизонтальной прямой, параллельной оси абсцисс. Для определения изменения энтропии следует воспользоваться уравнениями (5.21) и (5.23) при T=const, после чего плучаем:
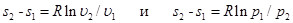 . (6.12)
. (6.12)
Теплота, участвующая в изотермном процессе, равна произведению изменения энтропии (s2 – s1) на абсолютную температуру Т:
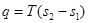 . (6.13)
. (6.13)
Адиабатный процесс
Процесс, протекающий без подвода и отвода теплоты, т. е. при отсутствии теплообмена рабочего тела с окружающей средой, называют адиабатным, а кривая этого процесса называется адиабатой. Для получения адиабатного процесса необходимым и обязательным условием является dq = 0 и, следовательно, q= 0.
Обратимый адиабатный процесс можно осуществить в цилиндре с абсолютно нетеплопроводными стенками при бесконечно медленном перемещении поршня.
Уравнение адиабаты выводится на основе уравнения первого закона термодинамики и имеет вид:
pυk=const. (6.14)
При адиабатном процессе произведение давления на объем газа в степени k есть величина постоянная. Величину k называют показателем адиабаты. Показатель адиабаты k=cp/cυ (см. раздел5.5).
В соответствии с уравнением (6.14) адиабата в pυ – диаграмме графически изображена неравнобокой гиперболой АВ (см. рис. 6.5, а).
Рассмотрим зависимость между основными параметрами в адиабатном процессе.
Из уравнения адиабаты следует, что
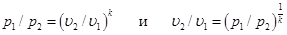 . (6.15)
. (6.15)
Зависимость между температурой, объёмом и давлением газа в процессе выражается соотношением:
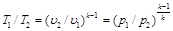 . (6.16)
. (6.16)
Уравнение первого закона термодинамики для адиабатного процесса принимает вид:
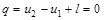
или
l = u1 – u2. (6.17)
Это значит, что работа изменения объема в адиабатном процессе получается за счет убыли внутренней энергии тела;
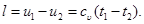 (6.18)
(6.18)
Если газ расширяется, то его внутренняя энергия и температура убывают; если газ сжимается, то его внутренняя энергия и температура возрастают.
Работу газа также можно определить из следующих соотношений:
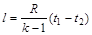 (6.19)
(6.19)
или
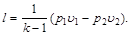 (6.20)
(6.20)
Графически внешняя работа изображается на рυ-диаграмме пл. 12v2v1 (рис. 6.5, а).
Из рис. 6.5 видно, что поскольку в уравнении адиабаты k > 1, она на рυ-диаграмме идет круче, чем изотерма.
Для обратимого адиабатного процесса dq =0, поэтому
ds = dq/T = 0 и s2-s1 = const,
т. е. обратимый адиабатный процесс является одновременно изоэнтропным (или при постоянной энтропии) и изображается в Тs-диаграмме вертикальной прямой 1 – 2, параллельной оси ординат (см. рис. 6.5, б).
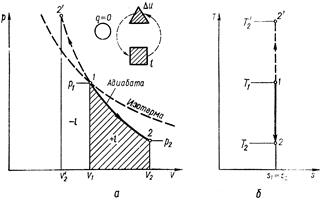
Рис. 6.5
Дата добавления: 2020-07-18; просмотров: 906;











