Истинная и средняя теплоемкости
Так как теплоемкость идеального газа зависит от температуры, а реального и от давления, то в технической термодинамике различают истинную и среднюю теплоемкости.
Теплоемкость, определяемая уравнениями (5.1), (5.3), (5.4) при данных значениях параметров состояния υ и Т или р и Т (т. е. в данном состоянии тела), называют истинной теплоемкостью. Следовательно, истинной теплоемкостью называется отношение элементарного количества теплоты, сообщаемой термодинамической системе в каком либо процессе, к бесконечно малой разности температур.
В практических расчетах при определении количества теплоты обычно применяют так называемые средние теплоемкости.
Средней теплоемкостью схт данного процесса в интервале температур от t1 до t2 называют отношение количества теплоты q1-2 к конечной разности температур t2-t1:
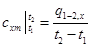 . (5.10)
. (5.10)
Так как количество теплоты q1-2,x, полученное системой в процессе х=const, определяется уравнением (5.2), где сх — истинная теплоемкость в данном процессе, то
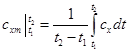 . (5.11)
. (5.11)
Если средние теплоемкости даны в таблице для интервала температур от 0 до t,°С, то средняя теплоемкость 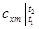 может быть вычислена по формуле
может быть вычислена по формуле
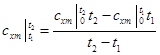 . (5.12)
. (5.12)
Таким образом, если в каком-либо процессе идеальный газ был нагрет от температуры t1 до t2, то количество теплоты, затраченное на нагревание, равно
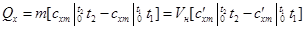 . (5.13)
. (5.13)
где m – масса газа, Vн – объём при нормальных условиях.
5.5. Отношение теплоемкостей ср и сυ
В термодинамике часто используется отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме, обозначаемое обычно буквой k:
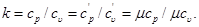 (5.14)
(5.14)
Если считать cx=const, то из табл. 5.1 получаем: для одноатомного газа k = 1,66; для двухатомного газа k=1,4, для трех- и многоатомных газов k= = 1,33.
Дата добавления: 2020-07-18; просмотров: 823;











