Соотношения взаимности.
Матрица кинетических коэффициентов симметрична, если термодинамические силы выбраны в соответствии со вторым постулатом Онзагера:
 (4.15)
(4.15)
Согласно этим соотношениям, 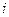 -тая термодинамическая сила
-тая термодинамическая сила 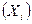 влияет на поток
влияет на поток 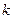 -того свойства
-того свойства  таким же образом, как
таким же образом, как 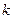 -тая сила
-тая сила 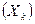 на поток
на поток 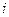 -того свойства
-того свойства  .
.
Соотношения взаимности есть следствие принципа микроскопической обратимости, утверждающего, что, если в момент времени  в механической системе поменять все скорости на обратные (т. е. изменить направление потоков в нашей терминологии), то все процессы пойдут в обратном направлении через те же состояния, что в прямом. Применительно к химическим реакциям (диффузию можно рассматривать, как мономолекулярную «реакцию») это положение означает принцип детального химического равновесия. В состоянии равновесия любой молекулярный процесс и процесс, обратный этому процессу, протекают с одинаковой скоростью. По Фаулеру: «Мы можем ожидать, что в системе, находящейся в равновесии, частота перехода от условий
в механической системе поменять все скорости на обратные (т. е. изменить направление потоков в нашей терминологии), то все процессы пойдут в обратном направлении через те же состояния, что в прямом. Применительно к химическим реакциям (диффузию можно рассматривать, как мономолекулярную «реакцию») это положение означает принцип детального химического равновесия. В состоянии равновесия любой молекулярный процесс и процесс, обратный этому процессу, протекают с одинаковой скоростью. По Фаулеру: «Мы можем ожидать, что в системе, находящейся в равновесии, частота перехода от условий 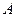 к условиям
к условиям 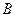 будет такой же, как от
будет такой же, как от 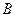 к
к 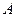 ... переходы от
... переходы от 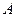 к
к 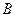 не должны рассматриваться как сбалансированные при помощи различных непрямых путей переходов, таких как от
не должны рассматриваться как сбалансированные при помощи различных непрямых путей переходов, таких как от 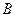 к
к 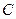 , азатем к
, азатем к 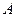 ».
».
Принцип детального химического равновесия не вытекает из первого и второго законов термодинамики, а является дополнительным к ним.
В системе, где имеется несколько независимых реакций, связанных циклом типа 
 , принцип детального равновесия
, принцип детального равновесия 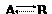
 выполняется лишь в том случае, если справедливы соотношения взаимности.
выполняется лишь в том случае, если справедливы соотношения взаимности.
Общее доказательство выходит за пределы представлений о химическом равновесии. При доказательстве соотношений взаимности устанавливается соответствие между потоком в неравновесной системе  и скоростью изменения термодинамических параметров системы
и скоростью изменения термодинамических параметров системы 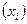 , причем предполагается, что система находится в состоянии, сравнительно близком к равновесию. В этом случае отклонение
, причем предполагается, что система находится в состоянии, сравнительно близком к равновесию. В этом случае отклонение 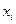 от равновесного значения
от равновесного значения 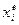 можно считать малым и, разлагая скорости
можно считать малым и, разлагая скорости 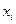 в ряд по степеням
в ряд по степеням 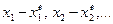 , ограничиваться членами первого порядка.
, ограничиваться членами первого порядка.
Дата добавления: 2020-07-18; просмотров: 637;











