РАСТВОРЕНИЕ ВОДОРОДА
На основании данных об изменении растворимости водорода в железе (рис. 12.3) можно сделать следующие выводы: 1) растворимость водорода возрастает при повышении температуры и уменьшается при ее снижении; 2) растворимость в различных модификациях железа неодинакова; 3) при переходе железа из жидкого состояния в твердое и из одного аллотропического состояния в другое растворимость изменяется скачкообразно. В реальных производственных условиях чистый водород Н2 в атмосфере практически отсутствует, но всегда имеется какое-то количество паров Н2О в атмосфере и влаги в шихтовых и добавочных материалах. Экспериментально установлено, что содержание водорода в металле по ходу плавки зависит от парциального давления Н2О в атмосфере: [H]=К' 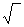 рн2О. При одинаковой технологии выплавки содержание водорода в стали, выплавленной в период влажных летних дней, может быть выше, чем в период морозных зимних дней, когда атмосферная влажность существенно ниже. Скорость растворения газов в металле зависит от многих факторов: агрегатного состояния и состояния поверхности металла, его кристаллической структуры, давления газов, температуры, от размеров молекул (атомов) растворяющегося газа.
рн2О. При одинаковой технологии выплавки содержание водорода в стали, выплавленной в период влажных летних дней, может быть выше, чем в период морозных зимних дней, когда атмосферная влажность существенно ниже. Скорость растворения газов в металле зависит от многих факторов: агрегатного состояния и состояния поверхности металла, его кристаллической структуры, давления газов, температуры, от размеров молекул (атомов) растворяющегося газа.
Водород в жидком железе находится в виде протона Н+, т. е. в виде частиц очень малых размеров. Скорость миграции таких частиц в расплавленном железе очень велика. В жидком металле скорость растворения водорода выше, чем в твердом. В твердом состоянии проницаемость металлов для газов определяется кристаллической структурой металла. Например, 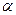 -Fe
-Fe
Рис. 12.3.Растворимость водорода в жидком железе
более проницаемо для водорода, чем 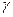 -Fe, так как полости, соединяющие соседние междоузлия (поры) в пространственно-центрированной решетке
-Fe, так как полости, соединяющие соседние междоузлия (поры) в пространственно-центрированной решетке  -Fe, больше полостей в гранецент-рированной решетке
-Fe, больше полостей в гранецент-рированной решетке  -Fe (сами же поры, наоборот, шире в решетке
-Fe (сами же поры, наоборот, шире в решетке  -Fe, с чем и связана большая растворимость газов в железе этой модификации, а также в сталях и сплавах, имеющих аустенитную структуру). Наличие в стали различных примесей (углерода, марганца, кремния и др.) изменяет растворимость газов в твердом и жидком металле, в частности в железе. Например, введение углерода приводит к понижению растворимости в нем газов, так как углерод занимает то пространство в решетке железа, в котором могут размещаться атомы других неметаллов. Легирующие присадки, расширяющие область у-фазы, например титан, ванадий, хром, способствуют увеличению растворимости газов, поскольку в гране-центрированной решетке этой фазы возможность растворения газа повышается. Присадки, стабилизирующие a-фазу, например углерод, кремний, алюминий, приводят к уменьшению растворимости газов. Влияние примесей на растворимость водорода в расплавленных двойных сплавах железа показано на рис. 12.4.
-Fe, с чем и связана большая растворимость газов в железе этой модификации, а также в сталях и сплавах, имеющих аустенитную структуру). Наличие в стали различных примесей (углерода, марганца, кремния и др.) изменяет растворимость газов в твердом и жидком металле, в частности в железе. Например, введение углерода приводит к понижению растворимости в нем газов, так как углерод занимает то пространство в решетке железа, в котором могут размещаться атомы других неметаллов. Легирующие присадки, расширяющие область у-фазы, например титан, ванадий, хром, способствуют увеличению растворимости газов, поскольку в гране-центрированной решетке этой фазы возможность растворения газа повышается. Присадки, стабилизирующие a-фазу, например углерод, кремний, алюминий, приводят к уменьшению растворимости газов. Влияние примесей на растворимость водорода в расплавленных двойных сплавах железа показано на рис. 12.4.
По влиянию на растворимость водорода в жидком железе элементы-примеси металла можно разделить на три группы: 1) повышающие растворимость водорода (титан, неодим, цирконий, торий, церий, лантан, ванадий (до 6 %)) и образующие с водородом соединения, прочные при низкой температуре; 2) снижающие растворимость водорода 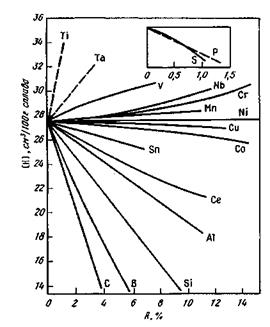
Рис. 12.4.Растворимость водорода в сплавах железо-легирующий элемент R при нормальном давлении и температуре 1600 °С
(углерод, кремний, алюминий) и имеющие в растворе более сильные связи с железом, чем связи водорода с железом; 3) слабовлияющие на растворимость водорода (никель, кобальт, марганец, молиб-лен, хром); влияние этих элементов на растворимость водорода может проявляться лишь при высоких их концентрациях (высоколегированные стали).
РАСТВОРЕНИЕ АЗОТА
На основании данных об изменении растворимости азота в железе (рис. 12.5) можно сделать следующие выводы: 1) растворимость азота в 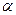 - и
- и 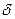 -Fe возрастает при повышении температуры; 2) растворимость азота в
-Fe возрастает при повышении температуры; 2) растворимость азота в 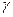 -Fe при повышении температуры снижается, что объясняется снижением прочности нитрида Fe4N; 3) растворимость азота при переходе из жидкого состояния в твердое и из одного аллотропического состояния в другое резко изменяется; 4) растворимость азота в жидком железе с повышением температуры возрастает. Для процесса растворения азота в жидком железе характерны, по крайней мере, две стадии: 1) диссоциация молекулярного азота на атомы N2 → 2N — сопровождается поглощением тепла и 2) растворение атомарного азота N → [N] — сопровождается выделением тепла. Поскольку ΔHцис> Δhраст, суммарный процесс протекает с поглощением тепла. При повышенных температурах наблюдается увеличение содержания азота в металле (например, при продувке техническим кислородом с повышенным содержанием азота, в высокотемпературной зоне дуги при электродуговом обогреве и т. п.). При 1600 °С и p H2=0,1МПа растворимость азота в жидком железе близка к 0,044 %. При этих условиях азот образует с железом раствор, близкий к идеальному. Образование нитридов железа (Fe4N, Fe2N) происходит в процессе охлаждения закристаллизовавшегося металла (в основном в области у?6)- По влиянию на растворимость азота в жидком железе элементы-примеси металла можно разделить на две группы.
-Fe при повышении температуры снижается, что объясняется снижением прочности нитрида Fe4N; 3) растворимость азота при переходе из жидкого состояния в твердое и из одного аллотропического состояния в другое резко изменяется; 4) растворимость азота в жидком железе с повышением температуры возрастает. Для процесса растворения азота в жидком железе характерны, по крайней мере, две стадии: 1) диссоциация молекулярного азота на атомы N2 → 2N — сопровождается поглощением тепла и 2) растворение атомарного азота N → [N] — сопровождается выделением тепла. Поскольку ΔHцис> Δhраст, суммарный процесс протекает с поглощением тепла. При повышенных температурах наблюдается увеличение содержания азота в металле (например, при продувке техническим кислородом с повышенным содержанием азота, в высокотемпературной зоне дуги при электродуговом обогреве и т. п.). При 1600 °С и p H2=0,1МПа растворимость азота в жидком железе близка к 0,044 %. При этих условиях азот образует с железом раствор, близкий к идеальному. Образование нитридов железа (Fe4N, Fe2N) происходит в процессе охлаждения закристаллизовавшегося металла (в основном в области у?6)- По влиянию на растворимость азота в жидком железе элементы-примеси металла можно разделить на две группы.
1. Образующие прочные нитриды (ванадий, ниобий, лантан, церий, титан, алюминий). Эти элементы повышают растворимость азота в железе. Такие примеси, как хром, марганец, молибден, обычно нитридов не образуют, но они характеризуются большим химическим сродством к азоту, чем к железу, поэтому также заметно увеличивают растворимость азота.
2. Не образующие нитридов (углерод, никель, медь, фосфор) или образующие с азотом соединения, менее прочные, чем с железом (кремний). Эти элементы заметно снижают растворимость азота в железе.
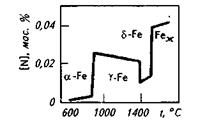
Рис. 12.5. Растворимость азота в жидком железе
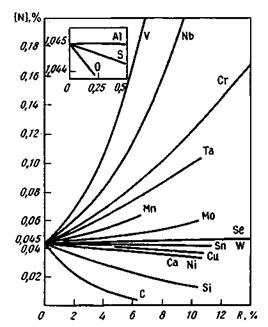
Рис. 12.6.Растворимость азота в сплавах железо—легирующий элемент R при нормальном давлении и температуре 1600 °С
Влияние содержания примесей железа на растворимость в нем азота видно из рис. 12.6. При охлаждении стали, содержащей азот, нежелательным является скачкообразное изменение растворимости. При быстром охлаждении азот не успевает выделиться и раствор становится пересыщенным. Процесс выделения избыточного азота протекает во время эксплуатации готового изделия и во многих случаях приводит к ухудшению свойств стали (старение и связанное с этим скачкообразное повышение прочности и понижение пластических свойств). Размеры частиц азота в металле значительно больше, чем водорода, поэтому скорости диффузии азота в железе более низкие. Коэффициент диффузии водорода в жидком железе Dн = = (8,0 + 9,0) • 10~3 см2/с, тогда как для азота D n = 3,77 • 10~5 см2/с, т. е. ниже на два порядка, поэтому при снижении давления (обработка вакуумом) водород удаляется из металла с большей интенсивностью, чем азот.
Наличие в железе поверхностно-активных примесей заметно влияет на процессы растворения (и соответственно выделения) азота. Так, например, кислород является поверхностно-активной примесью. В результате присутствия в расплаве кислорода образуется богатый кислородом поверхностный слой, приводящий к снижению скорости перехода азота через границу газ—жидкий металл, поэтому при малой степени раскисленное™ и небольшом перегреве металла над ликвидусом можно продувать сталь азотом без опасения получить чрезмерно высокое его содержание. Иное развитие у процесса, когда металл хорошо раскислен либо когда в агрегате или в какой-то локальной зоне (например, в зоне электрических дуг или в зоне подачи технического кислорода в ванну) имеют место заметные перегревы металла.
В среднем можно принять, что в кислородно-конвертерной среднеле-гированной стали содержится 0,002— 0,005 % N, в мартеновской стали — 0,004-0,008 % N и в электростали — 0,006-0,012% N.
Дата добавления: 2016-06-22; просмотров: 3650;











