Атомы. Атом водорода
Положительно заряженные ядра благодаря силам электромагнитного взаимодействия образуют с отрицательно заряженными - электронами устойчивые электрически нейтральные системы, называемые атомами. Атом является наименьшей частицей химического элемента, несущей его свойства.
Электрическая нейтральность атома означает, что количество электронов, сгруппированных вокруг ядра, равно числу протонов в ядре, т.е. его атомному номеру Z.
Устройство системы «ядро-электроны» отвечает фундаментальным принципам квантовой механики: принципу корпускулярно-волнового дуализма микрочастиц, соотношению неопределенностей, принципу Паули, рассмотренным выше (гл. 4).
Атом водорода. Простейший атом - атом водорода - состоит из одного протона и одного электрона. Электрон обладает энергией, которая является потенциальной энергией нахождения электрона в кулоновском поле ядра. Электрон находится в постоянном движении вокруг ядра, причем для этого движения принципиально не могут быть указаны траектории, «орбиты». Можно представить лишь электронное «облако» в виде не имеющей четких границ области пространства, где пребывание электрона наиболее вероятно (размеры этого «облака» и позволяют приближенно оценить «радиус» атома). Форма и размеры электронного «облака» зависят от энергии электрона, которая может принимать лишь совершенно определенные, квантованные значения. Квантованность определяется присутствием в формуле энергии электрона (4.16) главного квантового числа n.
Значение n = 1 соответствует основному состоянию атома, состояние с наименьшей энергией, n > 1 - возбужденным состояниям. Для перевода атома в возбужденное состояние необходимо сообщить ему энергию извне.
Форма и размеры электронного «облака», его ориентация в пространстве определяются также орбитальным квантовым числом l = 0, 1, 2, ... n - 1 и магнитным квантовым числом m = 0, 1, 2, 3, ... ±е. Всего при заданном значении главного квантового числа п возможно 2n2 квантовых состояния электрона.
В атомной физике применяют заимствованные из спектроскопии условные обозначения состояний электрона с различными значениями момента импульса. Состояние с l = 0 называют s-состоянием, с l = 1 – р состоянием, с l = 2 - d , с l = 3 – f- состоянием. Перед условным обозначением числа / пишут значение главного квантового числа п. Например, основное состояние атома водорода обозначается как 1s.
Физический смысл понятия нахождение электрона на определенном энергетическом уровне состоит в том, что ψ-функция определяет плотность вероятности того, что электрон в состоянии, задаваемом определенным набором квантовых чисел, находится в некоторой области пространства.
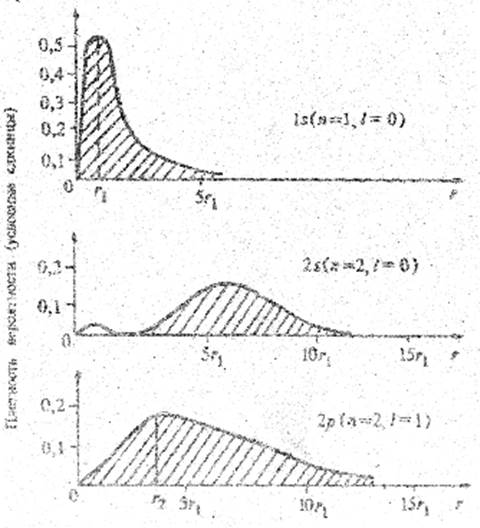
Рис. 5.4.
Например, при n = 1, l = 0, m = 0 (основное состояние, 1s) максимальная вероятность нахождения электрона в шаровом слое со средним значением радиуса 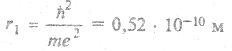 (радиус Бора) (рис. 5.4).
(радиус Бора) (рис. 5.4).
Вообще, для состояний с максимально возможными значениями l= n - 1 максимумы плотности вероятности приходятся на расстояния, совпадающие с радиусами круговых орбит по теории Бора (см. график для состояния 2·р).
Сложнее выглядит распределение плотности вероятности в зависимости от удаления г от ядра для возбужденных состояний, например 2s (см. рис. 5.4).
Отметим, что площади под всеми кривыми в соответствии с условием нормировки ψ-функции одинаковы и численно равны единице.
Многоэлектронные атомы. Периодичность изменения свойств химических элементов. Электроны в атоме образуют систему, находящуюся в различных квантовых состояниях, которые определяются квантовыми числами n, l, m,σ. При этом согласно принципу Паули, в атоме или системе взаимодействующих атомов каждое квантовое состояние может быть занято лишь одним электроном, т. е. никакие два электрона не могут иметь одинаковые наборы всех четырех квантовых чисел.
Представим электронное «окружение» ядра в атоме как систему уровней энергии, расположенных в порядке, соответствующем сформулированным выше правилам. Этот порядок удобнее изобразить в виде схемы рис. 5.5 (дана для n = 1, 2, 3).
Электроны с одинаковым значением п образуют оболочку: 1-я оболочка имеет обозначение К, 2-я - L, 3-я - М и т.д. Электроны с одинаковым значением принадлежат к одной подоболочке.
Порядок заполнения электронных оболочек и подоболочек в многоэлектронных атомах определяется принципом Паули, которым можно объяснить периодическую повторяемость физических и химических свойств атомов, обобщенную в периодической системе элементов Д.И. Менделеева. В соответствии с этим принципом электроны атома в основном состоянии занимают оболочку с наименьшей энергией. При переходе от атома с порядковым номером Z к атому с порядковым номером Z + 1 число электронов в верхней оболочке атома увеличивается на единицу. Добавленный электрон занимает наинизший из незанятых другими электронами энергетический уровень
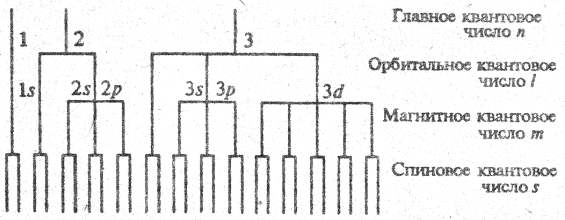
Рис. 5.5.
Напомним, что полное число N состояний электрона (или допустимое число электронов в каждой оболочке) определяется главным квантовым числом n как N= 2n2. Таким образом, в 1-й оболочке (К) может находиться лишь два электрона (2·12), во 2-й оболочке (L) - 8, в 3-й (М) - 18, в 4-й (N) - 32, в 5-й (О) - 50. Число электронов 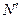 в каждой подоболочке определяется орбитальным квантовым числом l как
в каждой подоболочке определяется орбитальным квантовым числом l как 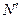 = 2(2/ + 1).
= 2(2/ + 1).
Порядок следования состояний зависит от энергии соответствующих им уровней, которая определяется квантовыми числами и и l. При этом зависимость энергии от n выражена более резко, чем зависимость от l. Поэтому последовательность состояний с ростом энергии определяется так:
1s, 2s, 2р, 3s, 3р, ...
Однако потом за счет ряда факторов, прежде всего, усиления зависимости энергии от l, такой порядок нарушается, и начатый рад продолжается так
…, (3р), 4s, 3d, 4р, 5s, 4d, 5р, 6s, 4f, 5d, ...

Рис. 5.3.
Рассмотрим в качестве примера процесс застройки электронных оболочек периодической системы (табл. 5.3). У первого элемента таблицы простейшего атома - водорода (Н) - единственный электрон находится в состоянии 1s, у гелия (Не) в этом состоянии находятся два электрона (с противоположными спинами). На этом заполнение оболочки к заканчивается. У лития (Li) 3-й электрон должен помешаться в оболочке L (n = 2) в состояния с наинизшей энергией, т. е. 2s (l = 0).
Этот электрон занимает более высокий энергетический уровень, поэтому он связан с ядром (ионом) значительно слабее, чем первые два. Благодаря этому именно этот электрон, называемый валентным, определяет химические свойства лития.
У следующего элемента — берилия (Ве) под оболочка 2s заполняется полностью. Затем происходит последовательное заполнение электронами подоболочки 2s (бор В, углерод С, азот N, кислород О, фтор F, неон Ne). У неона полностью заполнены оболочки к (два электрона) и L (восемь электронов). Это объясняет схожесть химических свойств инертных газов (Не и Ne).
Заполненная полностью оболочка эквивалентна- периоду системы элементов Менделеева. Таким образом, каждый период начинается с появления одного электрона в s-состоянии (щелочной металл) и заканчивается заполнением определенной оболочки (инертный газ). Так, следующий, одиннадцатый элемент - натрий (Na) имеет один валентный электрон в нижней из свободных оболочек - 3s, который и определяет его свойства как химически высокоактивного щелочного металла. Затем последовательно заполняются подоболочки 3s и 3р, после чего, в соответствии с вышеизложенным, «нормальный» порядок заполнения несколько нарушается. При переходе к атому калия (К) с Z = 19 процесс заполнения М-оболочки (n = 3) временно прерывается, и в атомах калия и кальция валентные электроны занимают не 3d-, a 4s- под оболочку.
В целом периодическая система Менделеева состоит из семи периодов и включает 105 атомных структур. Седьмой период заполнен частично, его пополнение происходит за счет синтеза новых трансурановых элементов с зарядом ядра Z > 105.
Таким образом, номер периода указывает количество электронных оболочек, и соответствует главному квантовому числу п, а номер группы - суммарному количеству s- и р-электронов внешней оболочки. Средние и большие периоды имеют четыре вставные декады, дополняющие предыдущие электронные оболочки электронами с различной ориентацией орбит. Внутри вставных декад больших периодов размещаются добавочные группы лантаноидов и актиноидов по 14 атомных структур в каждой. Четвертая электронная оболочка лантаноидов и пятая - актиноидов, дополнены f-электронами.
Все атомы, укомплектованные только s- и р-электронами, называются типичными и образуют восемь групп, родственных по своим химическим свойствам. Четыре вставные декады (нетипичные атомы) образуют 10 подгрупп. Четвертая вставная декада не завершена — в ее составе пока лишь актиний, курчатовий и нильсборий.
Закономерности заполнения оболочек и подоболочек позволяют понять периодическую повторяемость химических свойств элементов.
С точки зрения химических свойств важнейшей характеристикой атома является валентность. В химической связи участвуют только неспаренные электроны. Электроны же, находящиеся в заполненных подоболочках, в образовании химических связей не участвуют.
Дата добавления: 2017-11-21; просмотров: 1707;











