Атом водорода в квантовой механике
В квантовой механике задача об атоме водорода (помимо его простой структуры) является одной из основных еще и потому, что задача о движении электрона в поле центральных сил может быть распространена (естественно, с разной степенью приближения) на водородоподобные системы- системы, состоящие из ядра с зарядом Ze и одного электрона (например, He+, Li2+).
Состояние электрона в атоме водорода
Потенциальная энергия взаимодействия электрона с зарядом, обладающим зарядом Ze: 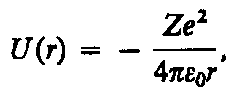
Стационарное уравнение Шредингера для электрона в атоме водорода:
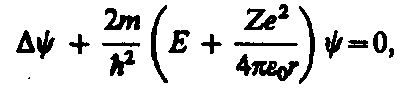
Это уравнение получается при подстановке в стационарное уравнение Шредингера.
(Z- порядковый номер элемента в таблице Менделеева, е - элементарный заряд; 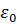 -электрическая постоянная, r- расстояние между электроном и ядром; m- масса электрона, Е - полная энергия электрона в атоме;
-электрическая постоянная, r- расстояние между электроном и ядром; m- масса электрона, Е - полная энергия электрона в атоме; 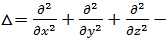 оператор Лапласа;
оператор Лапласа; 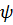 - координатная часть волновой функции)
- координатная часть волновой функции)
Энергия электрона в атоме водорода
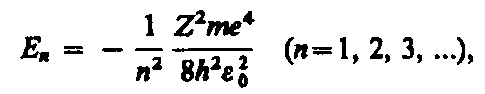
Решение уравнения Шредингера непрерывны, однозначны и конечны в случаях:
-при любых положительных значениях энергии (соответствует свободному электрону – заштрихованная область на рисунке);
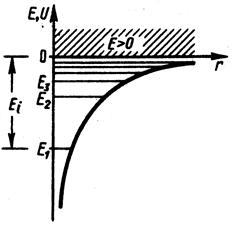 -при дискретных отрицательных значениях энергии (соответствует получаемым из уравнения Шредингера собственным значениям энергии).
-при дискретных отрицательных значениях энергии (соответствует получаемым из уравнения Шредингера собственным значениям энергии).
Собственные значения энергии в точности совпадают с уровнями энергии в модели атома Бора
Возможные значения энергии:
Дискретные значения энергии E1,E2,E3, …(на рисунке показаны в виде горизонтальных прямых)
Основной энергетический уровень- самый нижний уровень E1., отвечающий минимальной возможной энергии.
Возбужденные энергетические уровни-
энергетические уровни En>E1 (n=2,3, … .)
Связанное движение электронов:
Движение при Е<0 - электрон находится внутри гиперболической потенциальной ямы. По мере роста n энергетические уровни располагаются теснее и при n= 
Энергия ионизации атома водорода - энергия, необходимая для отрыва электрона, находящегося в основном состоянии, от атома:
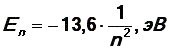
Квантовые числа
Уравнению Шредингера удовлетворяют собственные функции 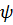 nlm(
nlm( 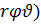 , определяемые тремя квантовыми числами: главным n, орбитальным l, и магнитным ml.
, определяемые тремя квантовыми числами: главным n, орбитальным l, и магнитным ml.
1) Главное квантовое число n совпадает с номером энергетического уровня, определяя энергию электрона в атоме, 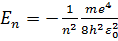 и может только принимать целые положительные значения.
и может только принимать целые положительные значения.
(n=1,2,3, … .)
2) Орбитальное квантовое число l определяет, согласно решению уравнения Шредингера, модуль момента импульса электрона (механический орбитальный момент)
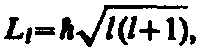
который может принимать лишь дискретные значения, т.е. квантуется. Орбитальное квантовое число l принимает всего n значений.
L=0,1,2, …,(n-1)
3) Магнитное квантовое число m1 определяет, согласно решению уравнения Шредингера, проекцию момента импульса электрона на направление z внешнего магнитного поля
Llz= 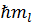 ,
,
причем вектор момента импульса электрона в атоме может иметь в пространстве 2l+1 ориентаций (ml принимает всего 2l+1 значений)
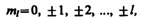
Хотя энергия электрона и зависит только от главного квантового числа п, но каждому собственному значению Еn (кроме Е1) соответствует несколько собственных функций 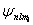 , отличающихся значениями l и ml. Следовательно, атом водорода может иметь одно и то же значение энергии, находясь в нескольких различных состояниях. Число состояний с одинаковой энергией:
, отличающихся значениями l и ml. Следовательно, атом водорода может иметь одно и то же значение энергии, находясь в нескольких различных состояниях. Число состояний с одинаковой энергией: 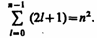
Т.е. кратность вырождения энергетических уровней атома водорода равна п2

Дата добавления: 2017-11-21; просмотров: 2638;











