Возможные орбиты в модели атома водорода
Свои постулаты Н.Бор применил для построения теории простейшей атомной системы – атома водорода, состоящего из ядра – протона, и одного электрона. Эта теория также применима для водородоподобных ионов, то есть атомов с зарядом ядра Ze и потерявших все электроны, кроме одного (например, Li2+, Be3+ и т.п.). В предположении, что электрон движется по круговой орбите, постулаты Бора позволяют найти радиусы rn стационарных, возможных орбит электрона.
На электрон действует кулоновская сила:
Fk = (1/4πε0) (е2/rn2)
где е – модуль заряда электрона, равный заряду ядра, ε0 = 8,85 * 10-12 Ф/м – электрическая постоянная.
Кулоновская сила сообщает электрону на орбите центростремительное ускорение:
aц = (vn2) / rn
Согласно второму закону Ньютона: Fk = maц
Поэтому (mvn2) / rn = e2 / (4πε0rn2)
или mvn2rn = e2 / (4πε0)
Используя правило квантования орбит
mvnrn = n ћ,
можно получить выражения для возможных радиусов орбит (электрон, согласно теории Бора, двигаясь по круговой орбите, обладает дискретными квантованными значениями момента импульса).
Радиус n-й стационарной орбиты (получается при решении исходных уравнений):
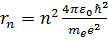 (n= 1,2, 3…),
(n= 1,2, 3…),
тогда радиус ближайшей к ядру орбиты (n=1)- первый боровский радиус
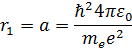 , т.е. а=52,8 пм (зависит лишь от фундаментальных постоянных)
, т.е. а=52,8 пм (зависит лишь от фундаментальных постоянных)
Связь rn и r1: rn=n2r1, тогда
Радиусы орбит квантованы 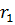 , 4
, 4 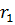 , 9
, 9 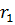 , … . (e- элементарный заряд, rn- радиус n-й стационарной орбиты;
, … . (e- элементарный заряд, rn- радиус n-й стационарной орбиты; 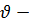 скорость электрона на n-й орбите, me- масса электрона; n- квантовое число; а- первый Боровский радиус)
скорость электрона на n-й орбите, me- масса электрона; n- квантовое число; а- первый Боровский радиус)
Дата добавления: 2017-11-21; просмотров: 2779;











