Влияние различных факторов на смещение равновесия (на состав равновесной смеси)
а) Влияние давления (или объема) при Т= const
Если система является идеальной, то константа равновесия Кр не зависит от давления (или объема). Если же реакция идет при высоких давлениях, то надо пользоваться уравнением:
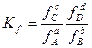 , (1.22)
, (1.22)
где f – фугитивность.
 Kf не зависит от давления, величина же Kp от давления зависит, но по мере уменьшения давления приближается к величине Кf, поскольку реальная газовая смесь приближается к идеальному состоянию, f ® p. Так, для реакции:
Kf не зависит от давления, величина же Kp от давления зависит, но по мере уменьшения давления приближается к величине Кf, поскольку реальная газовая смесь приближается к идеальному состоянию, f ® p. Так, для реакции:

 |
при 350 атм Kf = 0,00011 KР = 0,00037
При невысоких давлениях можно считать КР не зависящей от давления, то есть 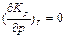 . В дальнейшем будем рассматривать именно этот случай.
. В дальнейшем будем рассматривать именно этот случай.
Из соотношения (1.12) видно, что величины 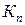 ,
, 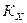 будут зависеть от давления, поэтому, не влияя на константу равновесия
будут зависеть от давления, поэтому, не влияя на константу равновесия 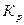 , изменение давления может влиять на состав равновесной смеси, на выход продуктов.
, изменение давления может влиять на состав равновесной смеси, на выход продуктов.

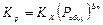
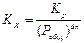 (1.23)
(1.23)
Уравнение (1.23) показывает, что влияние давления на 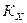 обусловлено величиной Dn:
обусловлено величиной Dn:
1.Dn > 0, реакция идет с увеличением числа молей газообразных продуктов, например:
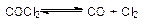 |
Dn = 1
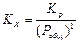 , то есть при повышении общего давления Кх уменьшается, уменьшается и количество продуктов в равновесной смеси, то есть равновесие смещается влево, в сторону образования COCl2.
, то есть при повышении общего давления Кх уменьшается, уменьшается и количество продуктов в равновесной смеси, то есть равновесие смещается влево, в сторону образования COCl2.
2.Dn < 0
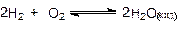 |
Dn = 0-2-1= -3
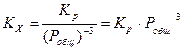 , то есть с увеличением давления Kx (и выход продукта) увеличивается.
, то есть с увеличением давления Kx (и выход продукта) увеличивается.
3.Dn = 0
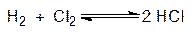
K 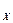 = K
= K 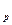 = const. В данном случае состав равновесной смеси не зависит от давления.
= const. В данном случае состав равновесной смеси не зависит от давления.
Добавление инертного газа при Р = const влияет на смещение равновесия аналогично уменьшению давления. Инертным газом в химическом равновесии считаются газы, не взаимодействующие с реагентами или продуктами реакции.
Увеличение объема при постоянном давлении влияет на смещение равновесия аналогично уменьшению давления.
Дата добавления: 2016-06-22; просмотров: 3236;











