Выражение состава равновесной смеси
Состав равновесной смеси можно выразить, используя:
а) степень диссоциации (a)
б) степень превращения (b)
в) выход продукта (х)
Рассмотрим на примерах все эти случаи:
а) по степени диссоциации
Степень диссоциации (a) – это доля продиссоциировавших молекул от исходного числа молекул. Ее можно выразить через количество вещества
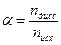 , (1.20)
, (1.20)
где nдисс – число распавшихся молей исходного вещества;n исх – число молей исходного вещества до реакции.
Пусть до реакции было, например, 5 моль NO2, а α – степень диссоциации NO2.
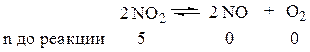
По уравнению (1.20)  , непрореагировавшим NO2 останется (5 – 5a).
, непрореагировавшим NO2 останется (5 – 5a).
По уравнению реакции при диссоциации 2 молей NO 2 получается 2 моля NO и 1 моль O2, а из 5a получается соответственно 5a молей NO и 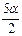 молей О2. Равновесная строчка будет такой:
молей О2. Равновесная строчка будет такой:
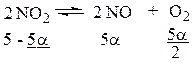
б) по степени превращения
Степень превращения вещества (b) – это доля прореагировавших молекул данного веществa к исходному числу молекул этого вещества. Выражаем через количество вещества в молях
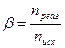 (1.21)
(1.21)
Пусть взято 2 моля СО и 2 моля Н2, b - степень превращения водорода в реакции
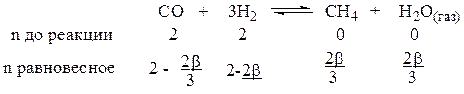
Поясним равновесную строчку. Исходим из вещества, для которого известна степень превращения, т. е. Н2. Из уравнения (1.21) получаем nреаг= nисх·b = 2 b.
Из стехиометрического уравнения видно, что СО расходуется в 3 раза меньше, чем Н2, то есть если Н2 реагирует 2b, то СО прореагирует 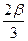 , а остальное останется к моменту равновесия не прореагировавшим. Также рассуждаем в отношении продуктов, используя стехиометрическое уравнение.
, а остальное останется к моменту равновесия не прореагировавшим. Также рассуждаем в отношении продуктов, используя стехиометрическое уравнение.
в) по выходу продукта.
Выход продукта (х) – количество конечного вещества в молях. Пусть "х" выход метанола в реакции
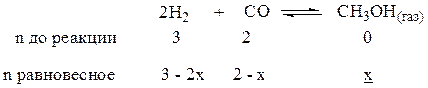
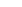

 во всех трех случаях рассуждения аналогичны и исходят из вещества, для которого что-либо известно (в примерах эта величина подчеркнута).
во всех трех случаях рассуждения аналогичны и исходят из вещества, для которого что-либо известно (в примерах эта величина подчеркнута).
Зная состав равновесной смеси, можно выразить константу равновесия. Так, для случая "в"
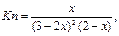 а из уравнения (1.19)
а из уравнения (1.19)
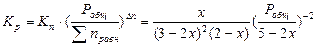

Выход вещества в долях (или %) – отношение количества образовавшегося продукта к общему количеству вещества в равновесной смеси:
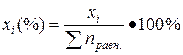
В данном примере:
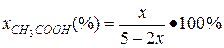
Дата добавления: 2016-06-22; просмотров: 3901;











