Способы выражения константы равновесия
Константа равновесия может быть выражена не только через равновесные парциальные давления (1.16), но и через равновесные концентрации 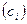 , через количество вещества (ni, моль), через молярные доли
, через количество вещества (ni, моль), через молярные доли 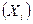 :
:
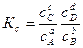
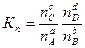
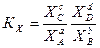
Все эти константы равновесия не равны, а пропорциональны друг другу. Покажем, как они связаны между собой. Из уравнения состояния идеального газа РV = nRТ
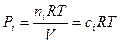 (1.17)
(1.17)
Подставим значения Рi из уравнения (1.17) в соотношение (1.16):
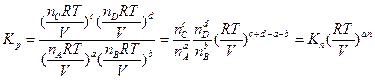
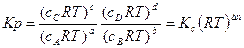
Выражая значения парциальных давлений через общее, получаем
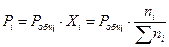 (1.18)
(1.18)
Подставляя выражение (1.18) в соотношение (1.16), находим
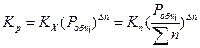
Таким образом
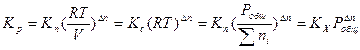 (1.19)
(1.19)
Если газофазная реакция идет без изменения числа молей, то Dn=0,тогда Kp=Kc=Kn=KХ=К
В случае реальных газов вместо давления используется фугитивность, f, и
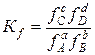
Приведенные выше константы равновесия, полученные из экспериментальных значений Р, С, Х, n, f в момент равновесия, могут быть названы эмпирическими. Они имеют соответствующую размерность:
КР и Кf [давлениеΔn]; Кn [мольΔn] и т.д.
где Δn = nкон. – nнач. – разность числа молей газообразных конечных и исходных веществ в реакции.
В закон действующих масс может быть подставлена активность.
Активность газа – отношение фугитивности в данном состоянии к стандартной фугитивности при одной и той же температуре:
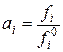
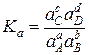
Эта величина называется термодинамической константой равновесия и является безразмерной величиной.
Если реакция протекает в растворе (без участия газообразных или твердых веществ), то закон действия масс выражается через концентрации (если раствор идеален) или через активности (для реального раствора): КС и Ка.
Дата добавления: 2016-06-22; просмотров: 2775;











