Мера химического сродства
Направление самопроизвольного протекания химической реакции
Способность различных веществ взаимодействовать между собой с образованием новых веществ была замечена давно и получила название химического сродства. Однако далеко не сразу был найден критерий, который мог быть мерой этого сродства. Вант-Гоффом было предложено в качестве меры химического сродства использовать максимальную работу, равную изменению энергии Гиббса, DG (при P,Т=const) или энергии Гельмгольца, DF (при V,T=const). Рассчитать величину химического сродства можно по уравнению изотермы химической реакции:
DG = - RT(lnKp - ln 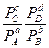 ) = - RTlnKp + RTln
) = - RTlnKp + RTln 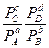 , (1.28)
, (1.28)
где Kp - константа равновесия, в которую входят парциальные давления компонентов в момент равновесия:
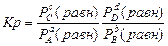 ,
,
а 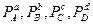 - парциальные давления компонентов до достижения равновесия, неравновесные, произвольно взятые.
- парциальные давления компонентов до достижения равновесия, неравновесные, произвольно взятые.
Следует отметить, что давления, входящие в уравнение изотермы (1.28) являются относительными, 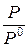 , отнесенными к стандартному значению, следовательно, безразмерными. В качестве стандартного давления берется 1 атм. Если давление Р взято в атмосферах, то численные значения величин Р и
, отнесенными к стандартному значению, следовательно, безразмерными. В качестве стандартного давления берется 1 атм. Если давление Р взято в атмосферах, то численные значения величин Р и  одинаковы. Если же Р взято в Паскалях, то Р0 = 1,013·105 Па и следует отнести давление к этой величине.
одинаковы. Если же Р взято в Паскалях, то Р0 = 1,013·105 Па и следует отнести давление к этой величине.
Второй член уравнения (1.28) обозначается 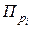
DG = - RTlnKp + RTlnПрi (1.29)
В этом уравнении DG - изменение энергии Гиббса при химическом превращении такого количества реагирующих веществ, которое соответствует стехиометрическому уравнению реакции, (это соответствует одному пробегу реакции). Превращение при этом должно протекать в столь большой массе смеси, что неравновесные давления остаются постоянными.
Проведем анализ уравнения изотермы химической реакции (1.29).
1.Если DG < 0, то Пpi < Kp. Поскольку в ходе химического превращения система стремится к равновесному состоянию, следовательно значение Прi будет стремиться к значению Kp. В данном случае это приведет к росту количества продуктов (числитель Прi) и уменьшению количества исходных веществ (знаменатель Прi). Таким образом, при DG < 0 реакция идет в прямом направлении.
2.Если DG > 0, то Прi > Kp и по мере течения реакции будет уменьшаться, стремясь к значению Kp. Это приведет к уменьшению количества продуктов и увеличению количества исходных веществ, то есть при DG > 0 реакция пойдет влево.
3.Если DG = 0, то Прi = Kp и система находится в состоянии равновесия.
Таким образом, для одних и тех же веществ сродство друг к другу зависит от исходных концентраций или давлений веществ, а не только от природы компонентов.
Чтобы сравнить сродство различных веществ, определяют изменение энергии Гиббса реакции в стандартных условиях, когда
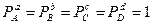 атм. и
атм. и 
Тогда DG° = - RT ln Kp. - уравнение нормального сродства.
Так для реакций:
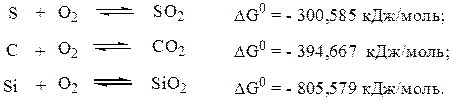 .
.
Сравнение величин DG° показывает, что наибольшее сродство к кислороду проявляет кремний, наименьшее – сера.
Дата добавления: 2016-06-22; просмотров: 3686;











