Оксиды азота. Азотистая кислота и ее соли. Физические и химические свойства, применение.
Список оксидов
Известны девять соединений азота с кислородом. Кроме пяти классических оксидов азота:
Оксид диазота, N2O, Оксид азота, NO, Триоксид диазота , N2O3, Диоксид азота , NO2,Пентаоксид диазота, N2O5, обнаружены ещё димер диоксида азота (NO2)2 и три малостабильных соединения: нитрозилазид N4O, тринитрамид N(NO2)3 и нитратный радикал NO3.
Оксид азота(I)
Несолеобразующий оксид. При нагревании разлагается на азот и кислород. При высоких концентрациях N2O возбуждает нервную систему («веселящий газ»). В медицине N2O применяют как слабое средство для наркоза.
Оксид азота(II)
Оксид азота NO (монооксид азота) — бесцветный газ, незначительно растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. Оксид азота (II) — очень реакционное соединение, может вступать в реакции присоединения с рядом солей (нитрозосоли), с галогенами (напр., нитрозилхлорид NOCl), органическими соединениями. При обычной температуре NO соединяется с кислородом с образованием NO2. Оксид NO получают каталитическим окислением при производстве азотной кислоты.
Оксид азота(III)
Оксид N2O3 (триоксид диазота, азотистый ангидрид) — темно-синяя жидкость, неустойчивая при обычных условиях, взаимодействует с водой, образуя азотистую кислоту HNO2.
Оксид азота(IV), Тетраоксид диазота
Оксид азота NO2 (диоксид азота) — бурый газ, токсичен, тяжелее воздуха, легко сжижается. При комнатной температуре NO2 находится в смеси с его бесцветным димером N2O4, приблизительно 1:1. Взаимодействует с водой:
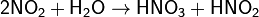
и растворами щелочей:
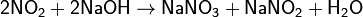
Сильный окислитель. Многие вещества (уголь, сера, фосфор, органические соединения) могут гореть в NO2. Этот оксид окисляет SO2 до SO3, на этой реакции основан нитрозный метод получения серной кислоты. Раздражает дыхательные пути, при больших концентрациях появляется отёк легких.
Оксид азота(V)
Оксид азота N2O5 (пентаоксид диазота, азотный ангидрид) — бесцветное кристаллическое вещество, легко разлагается на NO2 и О2. Сильный окислитель. В воде легко растворяется с образованием азотной кислоты HNO3.
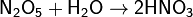
N(NO2)3Тринитрамид
Тринитрамид открыт в 2010 году. Является перспективным кандидатом на роль высокоэффективного ракетного топлива, однако на данный момент неизвестно, является ли устойчивой твёрдая фаза вещества.
N4OНитрозилазид
Существует при температуре ниже −50 °C как бледно-жёлтое твёрдое вещество, выше этой температуры разлагается на N2O и N2.
]Воздействие на организм
Все оксиды азота физиологически активны, относятся к третьему классу опасности.
Оксид азота N2O обладает наркозным эффектом и используется в хирургической практике. Оксид азота NO — сильный яд, оказывающий влияние на ЦНС, а также вызывающий поражение крови за счёт связывания гемоглобина. Относительно высокой токсичностью (при концентрации выше 0,05 мг/л) обладает и оксид азота NO2. Он раздражает дыхательные пути и угнетает аэробное окисление в легочной ткани, что приводит к развитию токсического отёка легких.
Азо́тистая кислота HNO2 — слабая одноосновная кислота, существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Соли азотистой кислоты называются нитритами или азотистокислыми. Нитриты гораздо более устойчивы, чем HNO2, все они токсичны.
Дата добавления: 2016-06-22; просмотров: 4430;











