Химические свойства
· Благодаря наличию неподеленной электронной пары во многих реакциях аммиак выступает как основание Бренстеда или комплексообразователь (не следует путать понятия «нуклеофил» и «основание Бренстеда». Нуклеофильность определяется сродством к положительно заряженной частице. Основание имеет сродство к протону. Понятие «основание» является частным случаем понятия «нуклеофил»). Так, он присоединяет протон, образуя ион аммония:
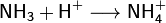
· Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
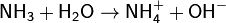 Ko=1,8·10−5
Ko=1,8·10−5
· Взаимодействуя с кислотами даёт соответствующие соли аммония:
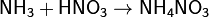
· Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода), способен образовывать с металлами соли — амиды. Соединения, содержащие ионы NH2−, называются амидами, NH2− — имидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
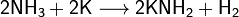
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Амиды металлов являются аналогами гидроксидов. Эта аналогия усиливается тем, что ионы ОН− и NH2−, а также молекулы Н2O и NH3 изоэлектронны. Амиды являются более сильными основаниями, чем гидроксиды, а следовательно, подвергаются в водных растворах необратимому гидролизу:
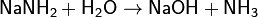
и в спиртах:
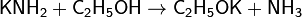
Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:
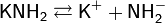
Фенолфталеин в этих растворах окрашивается в малиновый цвет, при добавлении кислот происходит их нейтрализация. Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH2 — нерастворим, NaNH2 — малорастворим, KNH2, RbNH2 и CsNH2 — хорошо растворимы.
· При нагревании аммиак проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
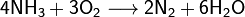
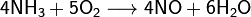
На восстановительной способности NH3 основано применение нашатыря NH4Cl для очистки поверхности металла от оксидов при их пайке:
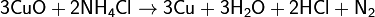
Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин:
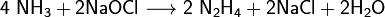
· Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).
· С галогеноалканами аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов):
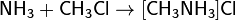 (гидрохлорид метиламмония)
(гидрохлорид метиламмония)
· С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов (восстановительное аминирование).
· При 1000 °C аммиак реагирует с углём, образуя синильную кислоту HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
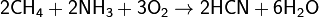
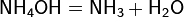
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы (автопротолиз), в чём проявлется его сходство с водой:
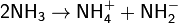
Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10−33 (моль/л)².
Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg, Al, а также Eu и Yb. Растворимость щелочных металлов в жидком NH3 составляет несколько десятков процентов. В жидком аммиаке NH3 также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например Na4Pb9.
Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щелочноземельные — в виде комплексов с аммиаком [Э(NH3)6] обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и NH3.
Растворенный в NH3 металл постепенно реагирует с образованием амида:
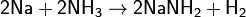
Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH2−, который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs. Реакция значительно ускоряется в присутствии даже небольших примесей H2O.
Металлоаммиачные растворы обладают металлической электропроводностью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окруженные молекулами NH3. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Дата добавления: 2016-06-22; просмотров: 3356;











