Химические свойства
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
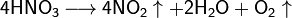
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией).
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
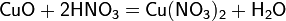
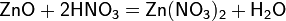
б) с основаниями:
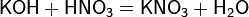
в) вытесняет слабые кислоты из их солей:
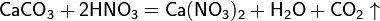
При кипении или под действием света азотная кислота частично разлагается:
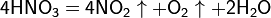
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3
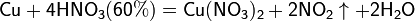
Разбавленная HNO3
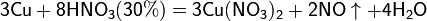
б) с металлами, стоящими в ряду напряжений левее водорода:
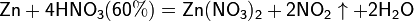
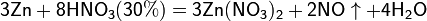
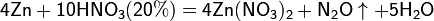
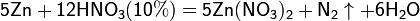
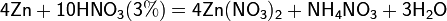
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
увеличение концентрации кислоты 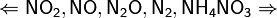 увеличение активности металла
увеличение активности металла
Продукты взаимодействия железа с HNO3 разной концентрации
С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
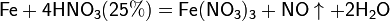
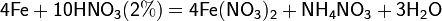
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
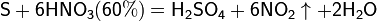
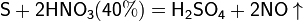
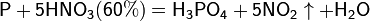
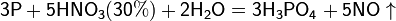
и сложные вещества, например:
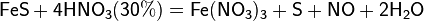
Некоторые органические соединения (например амины, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Азотная кислота
Некоторые металлы (железо, хром, алюминий, кобальт, никель, марганец, бериллий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию.
Смесь азотной и серной кислот носит название «меланж».
Азотная кислота широко используется для получения нитросоединений.
Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила:
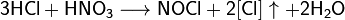
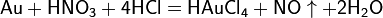
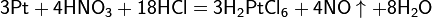
Нитраты
Азотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в воде не гидролизуется.
Соли азотной кислоты при нагревании необратимо разлагаются, причём состав продуктов разложения определяется катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния:
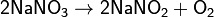
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью:
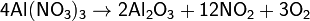
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
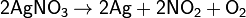
г) нитрат аммония:
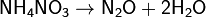
Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии являются сильными окислителями, например, при сплавлении твердых веществ:
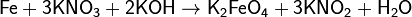
Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:
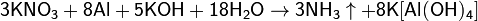
Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно.
С азотной кислотой не реагируют стекло, фторопласт-4.
Азот. Это один из важнейших биогенных элементов. Содержание его в живых организмах в расчёте на сухое вещество составляет примерно 3%. Азот входит в состав аминокислот, белков, нуклеотидов, нуклеиновых кислот, биогенных аминов и т.д.
Мы живет в атмосфере азота (объёмная доля азота в воздухе составляет 78%), обогащенной кислородом и в очень малых количествах – другими элементами. Без азот трудно представить себе жизнь на Земле. Азот и жизнь – понятия неразделимые. Жизнь во многом обязана именно азоту, а азот своим происхождением и существованием в биосфере обязан жизненным процессам.
Молекулярный азот участия в обмене веществ не принимает. Человек использует азот органических соединений.
Азот – не только носитель жизни. Азотные соединения, особенно нитраты, вредны для орг8анизма и могут быть причиной отравлений.
В медицине применяются:
N2O – оксид азота (I), или «веселящий газ», в смеси с кислородом используется в качестве наркотического средства;
NH4OH – водный раствор аммиака (нашатырный спирт), используется для возбуждения дыхания и выведения больных из обморочного состояния.
30. Характеристика элемента 15 Р. Свободный фосфор: аллотропия, физические и химические свойства, получение.
ФОСФОР (от греч. phosphoros - светоносный; лат. Phosphorus) P, хим. элемент V гр. периодич. системы; ат. номер 15, ат. м. 30,97376. Имеет один устойчивый нуклид 31P. Конфигурация внеш. электронной оболочки атома 3s23p3;степени окисления -3, +3 и +5; энергия последоват. ионизации при переходе от Р° до P5+ (эВ): 10,486, 19,76, 30,163, 51,36, 65,02; сродство к электрону 0,6 эВ; электроотрицательность по Полингу 2,10; атомный радиус 0,134 нм, ионные радиусы (в скобках указаны координац. числа) 0,186 нм для P3- , 0,044 нм (6) для P3+, 0,017 нм (4), 0,029 нм (5), 0,038 нм (6) для P5+.
Среднее содержание фосфора в земной коре 0,105% по массе, в воде морей и океанов 0,07 мг/л. Известно ок. 200 фосфорных минералов, все они представляют собой фосфаты. Из них важнейший - апатит, к-рый является основой фосфоритов. Практич. значение имеют также монацит CePO4, ксенотим YPO4, амблигонит LiAlPO4(F, ОН), трифилин Li(Fe, Mn)PO4, торбернит Cu(UO2)2(PO4)2· 12H2O, отунит Ca(UO2)2(PO4)2 x x 10H2O, вивианит Fe3(PO4)2· 8H2O, пироморфит Рb5(РО4)3С1, бирюза СuА16(РО4)4(ОН)8· 5Н2О.
Свойства. Известно св. 10 модификаций фосфора, из них важнейшие - белый, красный и черный фосфор (техн. белый фосфор наз. желтым фосфором). Единой системы обозначений модификаций фосфора нет. Некоторые св-ва важнейших модификаций сопоставлены в табл. Термодинамически устойчив при нормальных условиях кристаллич. черный фосфор (P I). Белый и красный фосфоры мета-стабильны, но вследствие малой скорости превращения могут практически неограниченное время сохраняться при нормальных условиях.
Получение
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С:
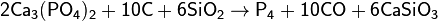
Образующиеся пары фосфора конденсируются в приёмнике под водой в аллотропическую модификацию в виде белого фосфора. Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
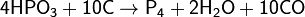
Дата добавления: 2016-06-22; просмотров: 2458;











