Химические свойства
В водных растворах существует равновесие:
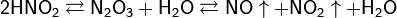
При нагревании раствора азотистая кислота распадается с выделением NO и образованием азотной кислоты:
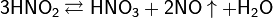
HNO2 является слабой кислотой. В водных растворах диссоциирует (KD=4,6·10−4), немного сильнее уксусной кислоты. Легко вытесняется более сильными кислотами из солей:
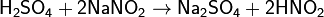
Азотистая кислота проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей (пероксид водорода, хлор, перманганат калия) окисляется в азотную кислоту:
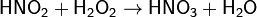
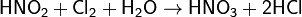
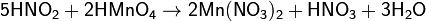
В то же время она способна окислять вещества, обладающие восстановительными свойствами:
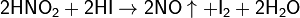
Получение
Азотистую кислоту можно получить при растворении оксида азота (III) N2O3 в воде:
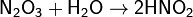
Также она получается при растворении в воде оксида азота (IV) NO2:
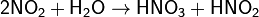
Применение
Азотистая кислота применяется для диазотирования первичных ароматических аминов и образования солей диазония. Нитриты применяются в органическом синтезе при производстве органических красителей.
Дата добавления: 2016-06-22; просмотров: 2135;











