Кислородные соединения хлора.
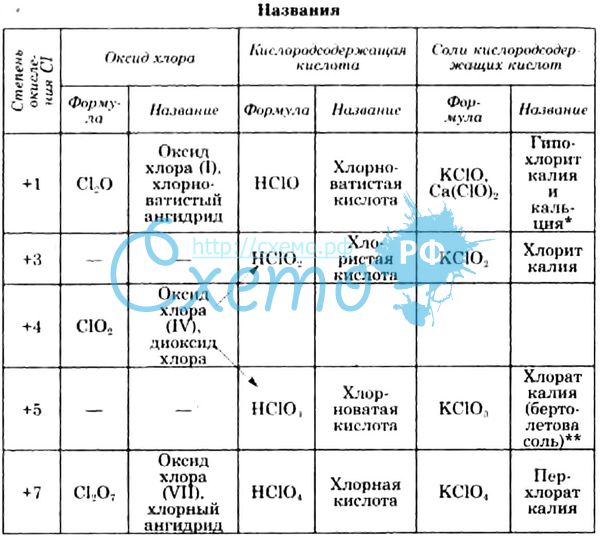
Хлор образует 4 кислородсодержащие кислоты: хлорнотистую, хлористую, хлорноватую и хлорную.
Хлорнотистая кислота (HClO) образуется при взаимодействии хлора с водой, а также ее солей с сильными минеральными кислотами. Она относится к слабым кислотам, очень неустойчива. Состав продуктов реакции ее разложения зависит от условий. При сильном освещении хлорноватистой кислоты, наличии в растворе восстановителя, а также длительном стоянии она разлагается с выделением атомарного кислорода:
НСlO = HСl + O.
В присутствии водоотнимающих веществ образуется оксид хлора (I):
2 НСlO = 2 Н2О + Сl2O.
Cl2О можно считать ангидридом хлорноватистой кислоты. При нагревании хлорноватистая кислота разлагается с образованием 2-х кислот - соляной и хлорноватой:
3 НСlO = 2 НСl + НСlO3.
Поэтому при взаимодействии хлора с горячим раствором щелочи образуется соли не соляной и хлорноватистой, а соляной и хлорноватой кислот:
6 NаОН + 3 Сl2 = 5 NаСl + NаСlО3 + 3 Н2О.
Соли хлорноватистой кислоты - гипохлориты - очень сильные окислители. Они образуются при взаимодействии хлора со щелочами на холоде. Одновременно образуются соли соляной кислоты. Из таких смесей наибольшее распространение получили хлорная известь и жавелевая вода.
Хлорноватая кислота (НСlO3) образуется при действии на ее соли - хлораты - серной кислоты. Это очень неустойчивая кислота, очень сильный окислитель. Может существовать только в разбавленных растворах.
При упаривании раствора НСlO3 при низкой температуре в вакууме можно получить вязкий раствор, содержащий около 40 % хлорной кислоты. При более высоком содержании кислоты раствор разлагается с взрывом.
Разложение с взрывом происходит и при меньшей концентрации в присутствии восстановителей. В разбавленных растворах хлорная кислота проявляет окислительные свойства, причем реакции протекают вполне спокойно:
НСlO3 + 6 НВr = НСl + 3 Вr2 + 3 Н2О.
Соли хлорноватой кислоты образуются при электролизе растворов хлоридов в отсутствие диафрагмы между катодным и анодным пространствами, а также при растворении хлора в горячем растворе щелочей, как показано выше. Образующийся при электролизе хлорат калия (бертолетова соль) слабо растворяется в воде и в виде белого осадка легко отделяется от других солей. Как и кислота, хлораты - довольно сильные окислители:
КСlO3 + 6 НСl = КСl + 3 Сl2 + 3 Н2О.
Хлораты применяются для производства взрывчатых веществ, а также для получения кислорода в лабораторных условиях и солей хлорной кислоты - перхлоратов. При нагревании бертолетовой соли в присутствии диоксида марганца (МnО2), играющего роль катализатора, выделяется кислород. Если же нагревать хлорат калия без катализатора, то он разлагается с образованием калиевых солей хлороводородной и хлорной кислот:
2 КСlО3 = 2 КСl + 3 O2;
4 КСlO3 = КСl + 3 КСlO4.
При обработке перхлоратов концентрированной серной кислотой можно получить хлорную кислоту:
КСlO4 + Н2SO4 = КНSO4 + НСlO4.
Это самая сильная кислота. Она наиболее устойчива из всех кислородсодержащих кислот хлора, однако, безводная кислота при нагревании, встряхивании или контакте с восстановителями может разлагаться с взрывом. Разбавленные растворы хлорной кислоты вполне устойчивы и безопасны в работе. Хлораты калия, рубидия, цезия, аммония и большинства органических оснований плохо растворяются в воде.
В промышленности перхлорат калия получают электролитическим окислением бертолетовой соли:
2 Н+ + 2 е- = Н2↑(на катоде);
СlО3- - 2 е- + Н2О = СlO4- + 2 Н+ (на аноде).
Хлористая кислота (НСlO2) образуется при действии концентрированной серной кислоты на хлориты щелочных металлов, которые получаются как промежуточные продукты при электролизе растворов хлоридов щелочных металлов в отсутствие диафрагмы между катодным и анодным пространствами. Это слабая, неустойчивая кислота, очень сильный окислитель в кислой среде. При взаимодействии ее с соляной кислотой выделяется хлор:
НСlO2 + 3 НСl = Сl2 + 2 Н2О.
Хлориты натрия используются для получения диоксида хлора, при обеззараживании воды, а также как отбеливающий агент.
Хлорная, или белильная, известь (СаОСl2), или СаСl(СlO), образуется при взаимодействии хлора с порошкообразным гидроксидом кальция - пушенкой:
Са(ОН)2 + Сl2 = Cl-O-Ca-Cl + H2O,
или
2 Са(ОН)2 + 2 Сl2 = СаСl2 + Са(ОСl)2 + 2 Н2О.
Качество хлорной извести определяется содержанием в ней гипохлорита. Она обладает очень сильными окислительными свойствами и может окислять даже соли марганца до перманганата:
5 СаОСl2 + 2 Mn(NО3)2 + 3 Са(ОН)2 = Са(МпO4)2 + 5 СаСl2 + 2 Са(NО3)2 + 3 H2O.
Под действием углекислого газа, содержащегося в воздухе, она разлагается с выделением хлора:
СаОСl2 + СО2 = СаСО3 + Сl2,
или
СаСl2 + Са(ОСl)2 + 2 СО2 = 2 СаСО3 + 2 Сl2.
Хлорная известь применяется как отбеливающее и дезинфицирующее вещество.
Дата добавления: 2016-06-22; просмотров: 9306;











