Химические свойства
Сильный окислитель, взаимодействует практически со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры. Пример реакций, протекающих при комнатной температуре:
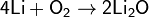
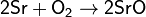
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
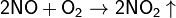
Окисляет большинство органических соединений:
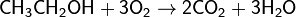
При определённых условиях можно провести мягкое окисление органического соединения:
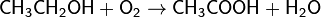
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором. Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
· Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
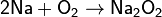
· Некоторые оксиды поглощают кислород:
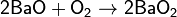
· По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется перекись водорода:
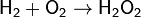
· В надпероксидах кислород формально имеет степень окисления −½, то есть один электрон на два атома кислорода (ион O−2). Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:
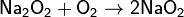
· Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:
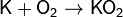
· Озониды содержат ион O−3 со степенью окисления кислорода, формально равной −1/3. Получают действием озона на гидроксиды щелочных металлов:
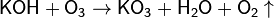
· В ионе диоксигенила O2+ кислород имеет формально степень окисления +½. Получают по реакции:
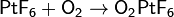
Фториды кислорода
· Дифторид кислорода, OF2 степень окисления кислорода +2, получают пропусканием фтора через раствор щелочи:
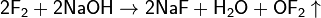
· Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления кислорода +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C:
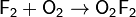
· Пропуская тлеющий разряд через смесь фтора с кислородом при определённых давлении и температуре, получают смеси высших фторидов кислорода O3F2, О4F2, О5F2 и О6F2.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон).
Дата добавления: 2016-06-22; просмотров: 1972;











