Общая характеристика
Вода — наиболее распространенное соединение на Земле. Ее количество достигает 1018 т, и она покрывает приблизительно четыре пятых земной поверхности. Это единственное химическое соединение, которое в природных условиях существует в виде жидкости, твердого вещества (лед) и газа (пары воды). Вода играет жизненно важную роль в промышленности, быту и в лабораторной практике; она совершенно необходима для поддержания жизни. Приблизительно две трети человеческого тела приходятся на долю воды, и многие пищевые продукты состоят преимущественно из воды.
| Содержание воды в некоторых пищевых продуктах | |
| Пищевые продукты | Содержание воды, масс. % |
| Помидоры Грибы Молоко Апельсины Яблоки Рыба Картофель Яйца Мясо (говядина) |
Вода — ковалентное соединение. Чистая вода в природе не существует, она всегда «загрязнена» различными солями, растворенными в ней. Для очистки от примесей воду «перегоняют», полученный продукт называется дистиллированной водой.
Чистая вода бесцветна, не имеет запаха и обладает специфическим неприятным вкусом. Редкой особенностью воды является то, что ее плотность в жидком состоянии при 4°С больше плотности льда, поэтому лед плавает на поверхности воды. Это аномальное свойство воды объясняется существованием в ней водородных связей, которые связывают молекулы как в жидком, так и в твердом состоянии. Поскольку вода обладает значительным дипольным моментом, она является хорошим растворителем для веществ с ионным и полярным характером связей; растворение веществ сопровождается гидратацией, а водные растворы веществ являются, как правило, электролитами. Чистая вода является слабым электролитом и плохо проводит электрический ток.
Пероксид водорода
Пероксид водорода (перекись водорода) Н2О2 — тяжелая полярная жидкость голубоватого цвета, строение которой показано на 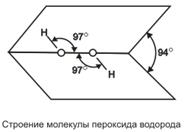 .
.
В жидком состоянии молекулы пероксида водорода сильно ассоциированы благодаря водородным связям.
Поскольку пероксид водорода имеет больше возможностей к образованию таких связей (ввиду большего числа атомов кислорода на один атом водорода), чем вода, то он имеет большие плотность, вязкость и температуру кипения (150,2°С). Пероксид водорода смешивается с водой во всех отношениях, чистый Н2О2 и весьма концентрированные растворы взрываются на свету; 30%-ный раствор пероксида
водорода в воде имеет техническое название «пергидроль».
Пероксид водорода каталитически разлагается при комнатной температуре, выделяя в первый момент атомарный кислород. На этом основано использование 3%-ного раствора Н2О2 в медицине.
Пероксид водорода вступает в реакции трех типов: без изменения пероксидной группировки:
Ва(ОН)2 + Н2О2 = ВаО2 + 2Н2О,
в качестве восстановителя:
2KMnО4 + 5Н2О2 + ЗН2SО4 = 2MnSО4 + К2SО4 + 5О2 + 8Н2O,
и, что более характерно, в качестве окислителя:
РbS + 4Н2О2 = PbSO4 + 4Н2О
В лаборатории пероксид водорода получают действием разбавленной серной кислоты на пероксид бария:
ВаО2 + Н2SО4 = ВаSО4↓+ Н2О2.
Пероксид водорода имеет разнообразное применение: для получения отбеливателей, вводимых в синтетические моющие средства; для получения различных пероксидов, особенно в органической химии; в реакциях полимеризации; для получения антисептических средств; для реставрации живописи на основе свинцовых красок.
Пероксид водорода (перекись водорода) Н2О2 — тяжелая полярная жидкость голубоватого цвета, строение которой показано на 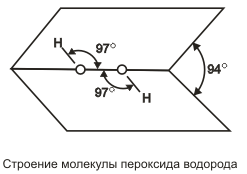 .
.
В жидком состоянии молекулы пероксида водорода сильно ассоциированы благодаря водородным связям. Поскольку пероксидводорода имеет больше возможностей к образованию таких связей (ввиду большего числа атомов кислорода на один атом водорода), чем вода,то он имеет большие плотность, вязкость и температуру кипения (150,2°С). Пероксид водорода смешивается с водой во всех отношениях,чистый Н2О2 и весьма концентрированные растворы взрываются на свету; 30%-ный раствор пероксида водорода в воде имеет техническое название «пергидроль».
Пероксид водорода каталитически разлагается при комнатной температуре, выделяя в первый момент атомарный кислород. На этом основано использование 3%-ного раствора Н2О2 в медицине.
Пероксид водорода вступает в реакции трех типов: без изменения пероксидной группировки:
Ва(ОН)2 + Н2О2 = ВаО2 + 2Н2О,
в качестве восстановителя:
2KMnО4 + 5Н2О2 + ЗН2SО4 = 2MnSО4 + К2SО4 + 5О2 + 8Н2O,
и, что более характерно, в качестве окислителя:
РbS + 4Н2О2 = PbSO4 + 4Н2О
В лаборатории пероксид водорода получают действием разбавленной серной кислоты на пероксид бария:
ВаО2 + Н2SО4 = ВаSО4↓+ Н2О2.
Пероксид водорода имеет разнообразное применение: для получения отбеливателей, вводимых в синтетические моющие средства;для получения различных пероксидов, особенно в органической химии; в реакциях полимеризации; для получения антисептических средств; для реставрации живописи на основе свинцовых красок.
В аптечной сети, как правило, продается 3%-ная перекись, часто даже без обозначения концентрации. Многие обеспокоены тем, что Н2О2 якобы грязная и содержит ряд вредных для организма веществ, в частности, свинец и цинк. В отличие от технической, поступающая в аптеки Н2О2 достаточно чистая, особенно приготовленная для акушеров. Конечно, наличие примесей того же свинца нежелательно, но в тех количествах перекиси водорода, которые рекомендуются для приема внутрь или внутривенно, этим можно пренебречь, учитывая тот лечебный эффект, который она вызывает, тем более что количество свинца, поступающего в организм из других источников, всегда превышает допустимые нормы.
Гидроперит выпускается в таблетках и содержит около 35% Н2О2. Перед употреблением таблетки растворяют в воде: 1 таблетка на 1 ст. ложку воды (15 мл), что соответствует 3%-ному раствору Н2О2. Причем использовать гидроперит можно только наружно, так как он недостаточно очищен.
Перекись водорода традиционно применяют в качестве антисептического, кровоостанавливающего средства, в качестве отбеливателя, для получения кислорода и в качестве окислителя в ракетной технике.
В организме перекись водорода под воздействием фермента каталазы разлагается на воду и атомарный кислород, защищая клеточные структуры от повреждений. В противном случае клетка загрязняется, и такой процесс, как апоптоз (ликвидация отживших больных клеток, паразитов), не происходит.
Доказано, что перекись водорода участвует во всех биоорганических процессах обмена веществ: белков, жиров, углеводов, минеральных солей, а также в образовании витаминов, в работе всех ферментных, гормональных систем, в выработке тепла в организме, она способствует переходу сахара из плазмы крови в клетки без помощи инсулина.
Однако, помимо насыщения организма атомарным кислородом, перекись водорода играет и другую, возможно, более важную роль — окисляет токсические вещества. Это свойство доктор Фарр назвал «окислительной детоксикацией». В частности, окисляя жиры, отлагающиеся на стенках сосудов, она не только предотвращает, но и устраняет явления атеросклероза.
Окислительные свойства перекиси водорода очень сильны: если 10-15 мл Н2О2 влить в 1 л воды, то количество микробов в ней уменьшается в 1000 раз! При этом гибнут даже такие патогенные микробы, как возбудители холеры и брюшного тифа, споры сибирской язвы, очень устойчивые во внешней среде. Способность перекиси водорода (при внутривенном введении) успешно бороться с бактериальными, грибковыми, паразитарными и вирусными инфекциями, а также стимулировать работу иммунной системы и препятствовать росту опухолей установлена большим количеством лабораторных и клинических исследований (У. Дуглас, 1998). После внутривенного введения Н2О2 в организм клетки-киллеры, Т-лимфоциты, ответственные за напряженность работы иммунной системы, приобретают более высокую активность.
Сочетание же использования перекиси водорода с ультрафиолетовым облучением крови оказывает еще более выраженный терапевтический эффект, особенно в случаях заболеваний, связанных с такими иммунодефицитными состояниями, как вирусный гепатит, хронические болезни, бесплодие, так называемый СПИД, бронхиальная астма и т. д.
Дата добавления: 2016-06-22; просмотров: 1642;











