Сущность гидролиза. Гидролиз различных типов солей. Степень гидролиза.
Химическая реакция обменного характера растворяемого вещества с растворителем называется сольволизом. Если растворителем является вода, то процесс – гидролиз (частный случай сольволиза).
Суть гидролиза солей заключается в том, что происходит смещение равновесия диссоциации воды вследствие связывания одного из ее ионов с образованием малодиссоциированного или труднорастворимого продукта. Гидролиз идет по-разному в зависимости от силы кислоты и основания, образовавших соль. Рассмотрим различные случаи.
а) Соль образована слабой кислотой и сильным основанием (CH3COONa, KCN, Na2CO3).
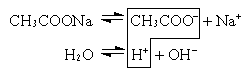
или CH3COO– + Na+ + H2O  CH3COOH + Na+ + OH–
CH3COOH + Na+ + OH–
CH3COO– + H2O  CH3COOH + OH–
CH3COOH + OH–
Так как уксусная кислота слабо диссоциирует, ацетат-ион связывает ион H+, и равновесие диссоциации воды смещается вправо согласнопринципу Ле Шателье. В растворе накапливаются ионы OH– (pH>7)*.
Если соль образована многоосновной кислотой, то гидролиз идет ступенчато. Например, гидролиз карбоната:
I ступень: CO32– + H2O  HCO3– + OH–
HCO3– + OH–
II ступень: HCO3– + H2O  H2CO3 + OH–
H2CO3 + OH–
Практическое значение обычно имеет только процесс, идущий по первой ступени, которым, как правило, и ограничиваются при оценке гидролиза солей. Равновесие гидролиза по второй ступени значительно смешено влево по сравнению с равновесием первой ступени, поскольку на первой ступени образуется более слабый электролит (HCO3–), чем на второй (H2CO3) (о смещении ионных равновесий см. раздел 4.3.3).
б) Соль образована сильной кислотой и слабым основанием (NH4NO3, AlCl3, Fe2(SO4)3).
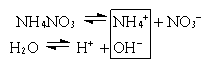
NH4+ + NO3– + H2O  NH4OH + NO3– + H+
NH4OH + NO3– + H+
NH4+ + H2O  NH4OH + H+
NH4OH + H+
(pH<7)
В случае многозарядного катиона гидролиз протекает ступенчато, например:
I ступень: Cu2+ + HOH  CuOH+ + H+
CuOH+ + H+
II ступень: CuOH+ + HOH  Cu(OH)2 + H+
Cu(OH)2 + H+
При этом концентрация ионов водорода и pH среды * в растворе также определяются главным образом первой ступенью гидролиза.
в) Соль образована слабой кислотой и слабым основанием (CH3COONH4, (NH4)2CO3).
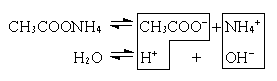
CH3COO– + NH4+ + H2O  CH3COOH + NH4OH
CH3COOH + NH4OH
В этом случае образуются два малодиссоциированных соединения, и pH раствора зависит от относительной силы кислоты и основания.
Если продукты гидролиза могут удаляться из раствора, то гидролиз протекает до конца. Например:
Al2S3 + 3 H2O  Al(OH)3↓ + H2S↑
Al(OH)3↓ + H2S↑
г) Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются, т.к. единственным малодиссоциирующимсоединением является H2O.
Взаимное усиление гидролиза. Допустим, что в разных сосудах установились равновесия:
CO32– + H2O  HCO3– + OH–
HCO3– + OH–
Al3+ + H2O  AlOH2+ + H+
AlOH2+ + H+
Обе соли гидролизованы незначительно, но если растворы смешать, то происходит связывание ионов H+ и OH–. В соответствии с принципом Ле-Шателье оба равновесия смещаются вправо, и гидролиз протекает полностью:
2 AlCl3 + 3 Na2CO3 + 3 H2O = 2 Al(OH)3 + 3 CO2 + 6 NaCl
Это называется взаимным усилением гидролиза.
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %, где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли. Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
В качестве примера ниже приводится вывод уравнения константы гидролиза соли, образованной слабой кислотой и сильным основанием:
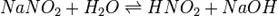
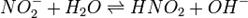
Уравнение константы равновесия для данной реакции имеет вид:
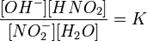 или
или 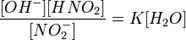
Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных 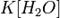 можно заменить одной новой — константой гидролиза:
можно заменить одной новой — константой гидролиза:
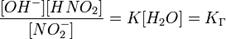
Численное значение константы гидролиза получим, используя ионное произведение воды 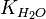 и константу диссоциации азотистой кислоты
и константу диссоциации азотистой кислоты 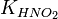 :
:
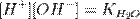
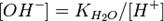 подставим в уравнение константы гидролиза равна:
подставим в уравнение константы гидролиза равна:
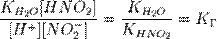
В общем случае для соли, образованной слабой кислотой и сильным основанием:
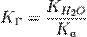 , где
, где 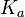 — константа диссоциации слабой кислоты, образующейся при гидролизе
— константа диссоциации слабой кислоты, образующейся при гидролизе
для соли, образованной сильной кислотой и слабым основанием:
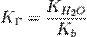 , где
, где 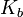 — константа диссоциации слабого основания, образующегося при гидролизе
— константа диссоциации слабого основания, образующегося при гидролизе
для соли, образованной слабой кислотой и слабым основанием:
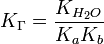
Дата добавления: 2016-06-22; просмотров: 6336;











