Расчет спектров водородоподобных атомов
Атомы, после возбуждения которых у них остаётся один электрон, названы водородоподобными. Мы уже показали, что энергия связи электрона атома водорода в момент пребывания его на первом энергетическом уровне равна энергии ионизации этого атома. Аналогичная закономерность наблюдается у всех водородоподобных атомов.
Исследования показали, что нумерацию электронов в атомах надо начинать с электронов, имеющих наименьший потенциал ионизации. Это значительно упрощает последующие математические модели для расчетов спектров.
Так, например, у атома гелия два электрона. Один имеет энергию ионизации 54,416 eV, а другой - 24,587 eV. С учетом изложенного, первым электроном атома гелия будем считать электрон с меньшей энергией ионизации 24,587 eV, а вторым – с большей 54,416 eV. Тогда у следующего элемента - лития - первым будет электрон с энергией ионизации 5,392 eV, второй с энергией ионизации 75,638 eV, а третий - 122,451 eV. Аналогичную нумерацию электронов примем и для атомов других химических элементов.
Известно, что номер химического элемента Z в таблице Менделеева соответствует количеству протонов в ядре атома, а энергия связи электрона водородоподобного атома в момент пребывания его на первом энергетическом уровне пропорциональна квадрату количества протонов в ядре.
Энергия связи электрона с протоном (ядром) атома водорода, соответствующая первому энергетическому уровню, равна 13,598 eV. Следовательно, энергия связи 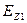 электрона водородоподобного атома любого другого химического элемента
электрона водородоподобного атома любого другого химического элемента 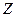 , соответствующая первому энергетическому уровню, будет равна
, соответствующая первому энергетическому уровню, будет равна
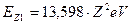 . (186)
. (186)
Ниже (табл. 9) приведены теоретические и экспериментальные значения энергий связи электронов водородоподобных атомов, соответствующие их первым энергетическим уровням, для некоторых химических элементов.
Как видно, с увеличением порядкового номера химического элемента расхождения между теоретическими и экспериментальными значениями увеличиваются. Истинная причина этого ещё неизвестна, но она начнет проясняться при анализе спектров многоэлектронных атомов. Мы рассмотрим это при анализе процессов формирования спектров всех четырех электронов атома бериллия.
Таблица 9. Теоретические и экспериментальные значения энергий связи электронов водородоподобных атомов, соответствующие их первым энергетическим уровням
| Химический элемент | Номер элемента Z | Энергии связи, 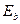 , eV , eV
| |
| эксперимент | Теория | ||
| H | 13,598 | - | |
| He | 54,416 | 54,392 | |
| Li | 122,451 | 122,382 | |
| Be | 217,713 | 217,568 | |
| B | 340,217 | 339,950 | |
| C | 489,981 | 489,528 | |
| N | 667,029 | 666,302 | |
| O | - | 870,272 |
Результаты нашего анализа были известны спектроскопистам экспериментаторам сразу после их публикации (1993г), но они не допустили автора нового закона формирования спектров атомов и ионов на свою научную конференцию, сославшись на нестандартность нового результата. Отказ от признания закона формирования спектров атомов и ионов открытого не академиком, а рядовым учёным, вынуждал их вводить различные слабо обоснованные условности при формировании представлений о последовательности изменения энергий спектральных линий.
Назовем стационарным энергетическим уровнем электрона в атоме такой энергетический уровень, находясь на котором, электрон может поглотить такой фотон, при котором энергия связи его с ядром станет равной нулю и он окажется свободным. Тогда энергии связи электронов водородоподобных атомов, соответствующие стационарным энергетическим уровням, будут рассчитываться по формуле
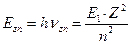 .(187)
.(187)
Символ 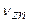 обозначает собственную частоту фотона, поглощенного электроном при уходе со стационарного энергетического уровня
обозначает собственную частоту фотона, поглощенного электроном при уходе со стационарного энергетического уровня 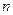 в свободное состояние.
в свободное состояние. 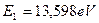 - энергия ионизации атома водорода. Результаты расчета по формуле (187) приведены в табл. 10.
- энергия ионизации атома водорода. Результаты расчета по формуле (187) приведены в табл. 10.
Таблица 10. Энергии связи электронов с ядрами
водородоподобных атомов
| Z | Эле- | Метод | Энергии связи 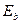 , eV , eV
| |||
| мент | опред. | n=1 | n=2 | n=3 | n=4 | |
| H | Экспер. Теор. | 13,598 - | 3,398 3,399 | 1,508 1,511 | 0,848 0,849 | |
| He | Экспер. Теор. | 54,416 - | 13,606 13,604 | 6,046 6,046 | 3,396 3,401 | |
| Li | Экспер. Теор. | 122,451 - | 30,611 30,613 | 13,601 13,607 | 7,651 7,653 | |
| Be | Экспер. Теор. | 217,713 - | 54,423 54,428 | 24,183 24,190 | 13,613 13,607 | |
| B | Экспер. Теор. | 340,217 - | 85,047 85,054 | 37,797 37,801 | 21,257 21,263 | |
| C | Экспер. Теор. | 489,981 - | 122,461 122,495 | 54,431 54,446 | 30,611 30,624 | |
| N | Экспер. Теор. | 667,029 - | 166,689 166,757 | 74,089 74,114 | 41,669 41,689 |
Не будем рассчитывать спектры электронов водородоподобных атомов всех химических элементов, а приведём лишь методику расчета для некоторых из них. Рассчитаем, например, спектр электронов водородоподобных атомов гелия и лития.
Так как гелий с одним электроном считается водородоподобным, то энергия связи его электрона с ядром атома, соответствующая первому энергетическому уровню, равна энергии его ионизации 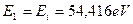 . Подставляя эти результаты в формулы (178) и (180), найдем (табл. 11).
. Подставляя эти результаты в формулы (178) и (180), найдем (табл. 11).
Таблица 11. Спектр второго электрона водородоподобного атома гелия и энергии связи 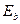 его с ядром атома
его с ядром атома
| Значения | n | |||||
 (эксп.) (эксп.)
| eV | 40,91 | 48,37 | 51,02 | 52,24 | 52,90 |
 (теор.) (теор.)
| eV | 40,91 | 48,37 | 51,02 | 52,24 | 52,90 |
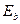 (теор.) (теор.)
| eV | 13,60 | 6,05 | 3,40 | 2,18 | 1,51 |
Третий электрон атома лития имеет наибольшую энергию ионизации 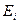 . Она равна энергии связи этого электрона с ядром атома
. Она равна энергии связи этого электрона с ядром атома 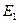 , соответствующей первому энергетическому уровню
, соответствующей первому энергетическому уровню 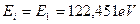 . Подставляя
. Подставляя 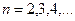 в формулы (178) и (180), найдем (табл. 12).
в формулы (178) и (180), найдем (табл. 12).
Таблица 12. Спектр третьего электрона водородоподобного атома лития и энергии связи 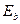 его с ядром атома на стационарных энергетических уровнях
его с ядром атома на стационарных энергетических уровнях
| Значения | n | |||||
 (эксп.) (эксп.)
| eV | 91,84 | 108,84 | 114,80 | 117,55 | 119,05 |
 (теор.) (теор.)
| eV | 91,84 | 108,85 | 114,80 | 117,55 | 119,05 |
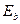 (теор.) (теор.)
| eV | 30,61 | 13,60 | 7,65 | 4,80 | 3,40 |
Соотношение (178) мы назвали законом формирования спектров атомов и ионов потому, что до выявления этого закона спектры водородоподобных атомов рассчитывались с помощью уравнений Бальмера - Ридберга или Шредингера, а для расчета спектров всех последующих электронов использовались приближенные численные методы. Уравнение же (178) позволяет рассчитывать спектры всех электронов, но при определенных условиях. Рассмотрим эти условия подробно на примере расчета спектра первого электрона атома гелия.
Дата добавления: 2016-06-22; просмотров: 3246;











