Расчёт спектра атома лития
В атоме лития три электрона. Литий, содержащий один электрон, считается водородоподобным атомом. Мы уже показали, как рассчитываются спектры водородоподобных атомов, в том числе и водородоподобного атома лития (табл. 12). Рассчитаем спектр второго электрона этого атома.
Энергия ионизации второго электрона атома лития равна 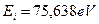 . Теперь необходимо найти энергию связи второго электрона атома лития, соответствующую второму энергетическому уровню. Для этого выпишем из справочника ряд экспериментальных значений энергий возбуждения, соответствующих стационарным энергетическим уровням этого электрона [А. Н. Зайдель]: 62,41; 69,65; 72,26; 73,48;…eV.
. Теперь необходимо найти энергию связи второго электрона атома лития, соответствующую второму энергетическому уровню. Для этого выпишем из справочника ряд экспериментальных значений энергий возбуждения, соответствующих стационарным энергетическим уровням этого электрона [А. Н. Зайдель]: 62,41; 69,65; 72,26; 73,48;…eV.
Так как второй электрон атома лития не может занимать первый энергетический уровень, то первая энергия возбуждения 62,41eV в ряду энергий возбуждения, соответствующих стационарным энергетическим уровням, должна принадлежать второму энергетическому уровню этого электрона. Далее, найдем разность между энергией ионизации 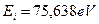 этого электрона и энергией возбуждения, соответствующей второму энергетическому уровню
этого электрона и энергией возбуждения, соответствующей второму энергетическому уровню 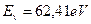 .
.
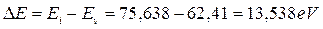 . (188)
. (188)
Теперь умножим полученную разность 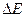 на квадрат главного квантового числа, соответствующего второму энергетическому уровню:
на квадрат главного квантового числа, соответствующего второму энергетическому уровню: 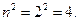 Полученный результат будет соответствовать энергии связи второго электрона атома лития с ядром атома в момент пребывания его на первом энергетическом уровне. Вот её значение
Полученный результат будет соответствовать энергии связи второго электрона атома лития с ядром атома в момент пребывания его на первом энергетическом уровне. Вот её значение 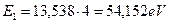 .
.
Итак, энергия ионизации 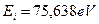 второго электрона атома лития не равна энергии
второго электрона атома лития не равна энергии 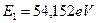 его связи с ядром атома, соответствующей первому энергетическому уровню. Подставляя эти данные в формулы (178) и (180), получим (табл. 16).
его связи с ядром атома, соответствующей первому энергетическому уровню. Подставляя эти данные в формулы (178) и (180), получим (табл. 16).
Таблица 16. Спектр второго электрона атома лития
| Значения | n | |||||
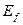 (эксп.) (эксп.)
| eV | 62,41 | 69,65 | 72,26 | 73,48 | - |
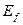 (теор.) (теор.)
| eV | 62,41 | 69,62 | 72,25 | 73,47 | 74,13 |
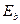 (теор.) (теор.)
| eV | 13,54 | 6,02 | 3,38 | 2,17 | 1,50 |
Рассчитаем спектр первого электрона атома лития. Его энергия ионизации 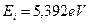 , а ряд энергий возбуждения, соответствующий стационарным энергетическим уровням, такой: 3,83; 4,52; 4,84; 5,01; 5,11; 5,18; 5,22; 5,25; 5,28; 5,30; 5,31; eV.
, а ряд энергий возбуждения, соответствующий стационарным энергетическим уровням, такой: 3,83; 4,52; 4,84; 5,01; 5,11; 5,18; 5,22; 5,25; 5,28; 5,30; 5,31; eV.
Разность между энергией ионизации этого электрона и энергией возбуждения, соответствующей третьему стационарному энергетическому уровню, будет такой: 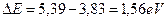 . Далее, найдем энергию связи этого электрона с ядром атома, соответствующую первому фиктивному энергетическому уровню.
. Далее, найдем энергию связи этого электрона с ядром атома, соответствующую первому фиктивному энергетическому уровню.
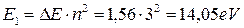 . (189)
. (189)
Итак, энергия ионизации первого электрона атома лития 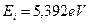 , а фиктивная энергия связи с ядром, соответствующая первому энергетическому уровню,
, а фиктивная энергия связи с ядром, соответствующая первому энергетическому уровню, 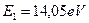 . Подставляя эти данные в математическую модель формирования спектров атомов и ионов (178) и в формулу (180) расчета энергий связи этого электрона, соответствующих стационарным энергетическим уровням, получим спектр этого электрона (табл. 17).
. Подставляя эти данные в математическую модель формирования спектров атомов и ионов (178) и в формулу (180) расчета энергий связи этого электрона, соответствующих стационарным энергетическим уровням, получим спектр этого электрона (табл. 17).
Таблица 17. Спектр первого электрона атома лития
| Значения | n | |||||
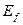 (эксп.) (эксп.)
| eV | - | 3,83 | 4,52 | 4,84 | 5,01 |
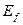 (теор.) (теор.)
| eV | 1,18 | 3,83 | 4,51 | 4,83 | 5,00 |
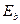 (теор.) (теор.)
| eV | 3,51 | 1,56 | 0,88 | 0,56 | 0,39 |
Обратим внимание на то, что в табл. 17 нет экспериментального значения энергии, соответствующей второму энергетическому уровню ( 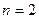 ). Причину этого мы установим при анализе структуры атома лития.
). Причину этого мы установим при анализе структуры атома лития.
Дата добавления: 2016-06-22; просмотров: 3472;











