Расчет спектра атома гелия
Атом гелия имеет два электрона. Энергия ионизации первого 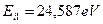 , а второго -
, а второго - 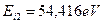 . Состояние атома гелия, при котором оба его электрона находятся на первых энергетических уровнях, называется основным, невозбужденным. Энергия возбуждения – это энергия поглощенного фотона. Она равна разности между энергией ионизации
. Состояние атома гелия, при котором оба его электрона находятся на первых энергетических уровнях, называется основным, невозбужденным. Энергия возбуждения – это энергия поглощенного фотона. Она равна разности между энергией ионизации 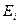 электрона и энергией связи электрона с ядром атома, соответствующей тому энергетическому уровню, на который переходит электрон после поглощения фотона. Такие уровни мы назвали стационарными.
электрона и энергией связи электрона с ядром атома, соответствующей тому энергетическому уровню, на который переходит электрон после поглощения фотона. Такие уровни мы назвали стационарными.
Атом гелия с одним электроном находится в ионизированном состоянии, поэтому его называют ионом гелия. Мы уже показали, что закономерность изменения энергий стационарных энергетических уровней у всех атомов, состоящих из ядра и одного электрона, одна и та же. Спектры таких ионов рассчитываются по математической модели (180) закона формирования энергий связи электронов с ядрами атомов.
Для этого выпишем из справочника энергии возбуждения первого электрона атома гелия, соответствующие стационарным энергетическим уровням. При 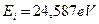 , имеем (табл. 13).
, имеем (табл. 13).
Таблица 13. Энергетические показатели стационарных энергетических уровней первого электрона атома гелия
| Номер уровня, n | Энергии связи
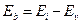 , eV , eV
| Энергии возб. 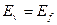 , eV , eV
|
| ? | ? | |
| 3,627 | 20,96 | |
| 3,367 | 21,22 | |
| 1,597 | 23,01 | |
| 1,497 | 23,09 | |
| 0,847 | 23,74 | |
| 0,547 | 24,04 | |
| 0,377 | 24,21 | |
| 0,277 | 24,31 | |
| 0,217 | 24,37 | |
| 0,167 | 24,42 | |
| 0,137 | 24,45 | |
| 0,117 | 24,47 | |
| 0,097 | 24,49 | |
| 0,077 | 24,51 | |
| 0,067 | 24,52 |
Напомним, что энергии связи 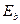 первого электрона с ядром атома определяются, как разность между энергией ионизации
первого электрона с ядром атома определяются, как разность между энергией ионизации 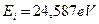 и энергиями возбуждения
и энергиями возбуждения 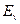 , равными энергиям поглощаемых или излучаемых фотонов
, равными энергиям поглощаемых или излучаемых фотонов 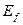 (табл. 13).
(табл. 13).
Обратим внимание на энергию возбуждения 23,01eV (табл. 13), соответствующую четвертому стационарному энергетическому уровню. В справочнике [А.П. Стриганов] её вообще нет, а в справочнике [А.Н. Зайдель] она приводится без указания яркости линии, то есть как очень слабая или ненаблюдаемая. Как нам поступить в этом случае? Правильнее будет исключить её пока из рассмотрения при поиске закономерности формирования энергий возбуждения, соответствующих стационарным энергетическим уровням. В аналогичном положении находится и энергия возбуждения, равная 20,96eV. Поэтому исключим и её из рассмотрения. В результате будем иметь (табл. 14).
Таблица 14. Энергии связи 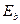 первого электрона атома гелия
первого электрона атома гелия
с его ядром
| Номер энергетического уровня, n | Энергии возбуждения,
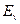 eV eV
| Энергии связи, eV | |
| эксперимент | теория 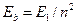
| ||
| 24,586 | ? | 13,47 | |
| 21,22 | 3,37 | 3,37 | |
| 23,09 | 1,50 | 1,50 | |
| 23,74 | 0,85 | 0,85 | |
| 24,04 | 0,55 | 0,55 | |
| 24,21 | 0,38 | 0,38 | |
| 24,31 | 0,28 | 0,28 | |
| 24,37 | 0,22 | 0,22 | |
| 24,42 | 0,17 | 0,17 | |
| 24,45 | 0,14 | 0,14 | |
| 24,47 | 0,10 | 0,10 | |
| 24,49 | 0,09 | 0,09 | |
| 24,51 | 0,08 | 0,08 | |
| 24,52 | 0,07 | 0,07 |
Сразу же обратим внимание на то, как был получен эмпирический закон для расчета энергий связи первого электрона атома гелия, приведенный в табл. 14 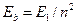 , и полностью совпадающий с законом (180), формирующим энергии связи электронов водородоподобных атомов. Для этого была взята энергия 3,37eV, соответствующая в табл. 13 энергии возбуждения 21,22eV, и умножена на 4.
, и полностью совпадающий с законом (180), формирующим энергии связи электронов водородоподобных атомов. Для этого была взята энергия 3,37eV, соответствующая в табл. 13 энергии возбуждения 21,22eV, и умножена на 4.
Полученное число 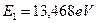 оказалось энергией связи, соответствующей первому энергетическому уровню первого электрона атома гелия. Конечно, это фиктивная энергия, но образовавшийся при этом ряд энергий (табл. 14, последняя колонка) полностью совпадает с рядом соответствующих экспериментальных значений, подтверждая правомочность исключения из этого ряда энергий возбуждения 20,96eV и 23,01eV.
оказалось энергией связи, соответствующей первому энергетическому уровню первого электрона атома гелия. Конечно, это фиктивная энергия, но образовавшийся при этом ряд энергий (табл. 14, последняя колонка) полностью совпадает с рядом соответствующих экспериментальных значений, подтверждая правомочность исключения из этого ряда энергий возбуждения 20,96eV и 23,01eV.
Полученный результат показывает, что энергия связи первого электрона атома гелия, соответствующая первому энергетическому уровню 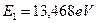 , не равна энергии ионизации этого электрона
, не равна энергии ионизации этого электрона 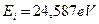 . Почему? Это центральный вопрос, на который мы дадим ответ при анализе процесса формирования атома гелия.
. Почему? Это центральный вопрос, на который мы дадим ответ при анализе процесса формирования атома гелия.
Результаты таблицы 14 требуют возврата к эксперименту по определению спектра первого электрона атома гелия для того, чтобы окончательно установить наличие или отсутствие экспериментальных линий, соответствующих энергиям 20,96eV и 23,01eV.
Невольно возникает вопрос: почему у второго электрона атома гелия значения энергий ионизации 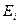 и связи
и связи 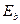 с ядром, соответствующей первому энергетическому уровню, совпадают (
с ядром, соответствующей первому энергетическому уровню, совпадают ( 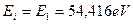 ), а у первого нет (
), а у первого нет ( 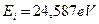 и
и 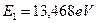 )? Ответ на этот вопрос мы получим при анализе структуры атома гелия.
)? Ответ на этот вопрос мы получим при анализе структуры атома гелия.
Если формула (178) действительно является законом формирования спектров атомов и ионов, то с её помощью мы должны получить экспериментальные значения энергий возбуждения. Подставляя в формулы (178) (180) 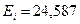 и
и 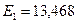 , получим (табл. 15).
, получим (табл. 15).
Таблица 15. Спектр первого электрона атома гелия
| Значения | n | |||||
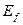 (эксп.) (эксп.)
| eV | 21,22 | 23,09 | 23,74 | 24,04 | 24,21 |
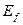 теор.) теор.)
| eV | 21,22 | 23,09 | 23,74 | 24,05 | 24,21 |
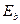 (теор.) (теор.)
| eV | 3,37 | 1,50 | 0,84 | 0,54 | 0,37 |
Дальше мы получим спектры и других многоэлектронных атомов, используя метод определения энергии 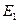 связи электрона с ядром, соответствующей первому энергетическому уровню, разработанный на примере анализа спектра первого электрона атома гелия.
связи электрона с ядром, соответствующей первому энергетическому уровню, разработанный на примере анализа спектра первого электрона атома гелия.
Дата добавления: 2016-06-22; просмотров: 4787;











