Понижение температуры замерзания растворов
При охлаждении разбавленных растворов нелетучих веществ при определенной температуре выкристаллизовывается растворитель, т.е. появляется твердая фаза, образованная чистым растворителем. Рассмотрим разбавленный раствор нелетучего вещества, находящийся в равновесии с твердым растворителем. Тогда в соответствии с теоремой Гиббса химический потенциал растворителя в растворе 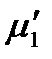 и химический потенциал твердого растворителя
и химический потенциал твердого растворителя 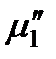 одинаковы:
одинаковы:
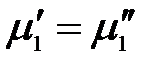
Химический потенциал растворителя в растворе при постоянном давлении является функцией состава раствора и температуры, а твердого растворителя, находящегося в равновесии с раствором – функцией только температуры:
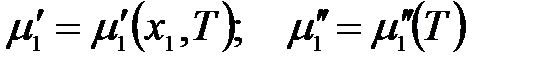 .
.
Продифференцируем
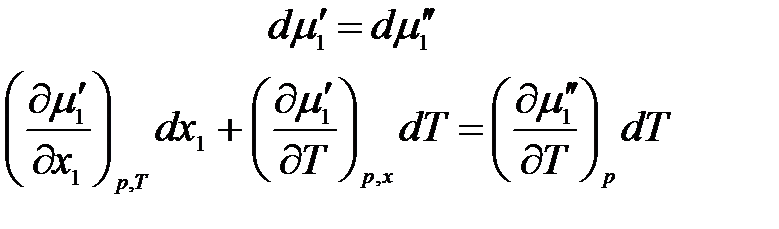
Проведя аналогичные предыдущим преобразования, получим:
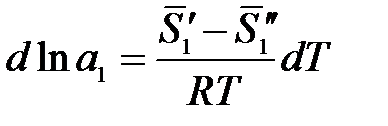
где 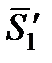 – парциальная мольная энтропия растворителя в растворе данного состава;
– парциальная мольная энтропия растворителя в растворе данного состава;
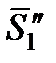 – мольная энтропия твердого чистого растворителя.
– мольная энтропия твердого чистого растворителя.
Разность, стоящая в числителе, равна парциальной мольной энтропии плавления:
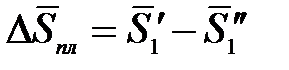
Так как раствор разбавленный, то можно принять, что парциальная мольная энтропия плавления растворителя из раствора равна мольной энтропии плавления чистого растворителя:
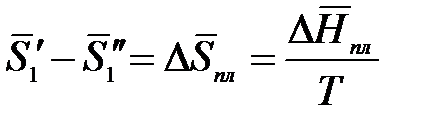 ,
,
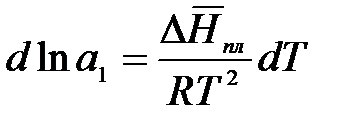 .
.
Аналогично предыдущему разделу можем принять, что
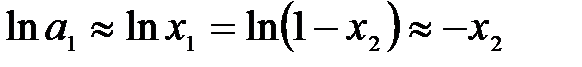 ,
,
тогда
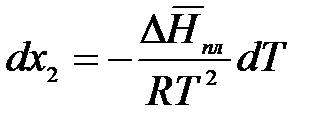 .
.
Процессы плавления и кристаллизации противоположны и идут при
Т = Тпл = Тз = const. Пусть температура замерзания чистого растворителя равна Тз0, а раствора – Тз. Мольная доля растворенного вещества в чистом растворителе х2 = 0, а в растворе – х2. Проинтегрируем в интервале Тз0 до Тз:
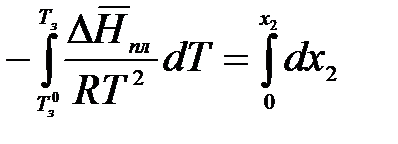 ;
;
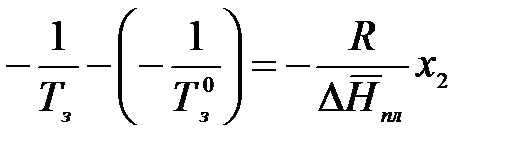 ;
;
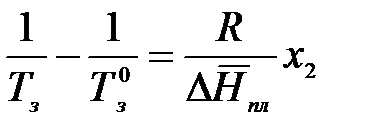
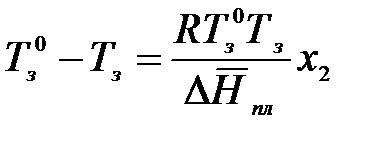
Аналогично заменяем 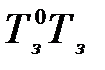 на
на 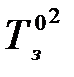
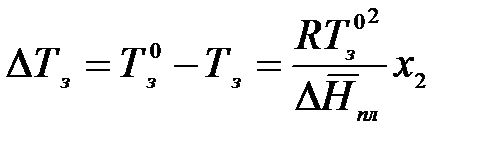
| р |
| Т |
| О |
| п |
| ж |
| Тз1 |
| Тз0 |
На рисунке:
| Рис. 2.7. Понижение температуры замерзания раствора по сравнению с чистым растворителем |
Тз – температура замерзания раствора.
Из рисунка видно, что Тз < Тз0.
Выразим мольную долю растворенного вещества через моляльность:
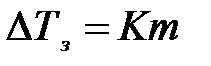 ,
,
где К – криоскопическая константа растворителя.
Криоскопическая постоянная зависит от свойств растворителя и не зависит от природы растворенного вещества. Физический смысл криоскопической константы: К численно равна понижению температуры замерзания раствора с концентрацией 1 моль/1000 г растворителя.
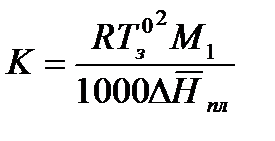
Значения К для различных растворителей приведены в справочной литературе.
С учетом диссоциации растворенного вещества получим
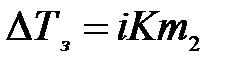
Методы анализа, основанные на измерении понижения температуры замерзания, называются криоскопическими. Криоскопический метод также применяется для определения молярной массы, концентрации и степени диссоциации растворенного вещества и является более точным, чем эбуллиоскопический.
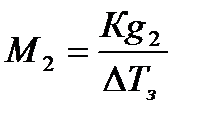 .
.
Дата добавления: 2016-06-22; просмотров: 3580;











