Осмос. Осмотическое давление
Рассмотрим сосуд, разделенный на две части полупроницаемой мембраной (рис. 2.8). Заполним одну часть сосуда (I) чистым растворителем, а вторую (II) – раствором. заполненный индивидуальной жидкостью, например, водой. Мембрана пропускает молекулы растворителя, но не пропускает молекулы растворенного вещества. Раствор и растворитель, разделенные полупроницаемой мембраной, можно рассматривать как две фазы. Мембрана является границей раздела двух фаз.
| II |
| I |
| рвн |
 .
.
| Рис. 2.8. Осмометр (I – растворитель, II– раствор) |
Осмос – самопроизвольное проникновение растворителя в раствор через полупроницаемую мембрану.
Проникновение растворителя в раствор и разбавление раствора можно предотвратить, если к нему приложить дополнительное давление.
Давление, которое необходимо приложить к раствору для предотвращения осмоса и приведения системы в равновесие, называется осмотическим давлением и обозначается π. Осмотическое давление не зависит от природы мембраны.
Получим уравнение для расчета осмотического давления.
Растворитель будет проникать в раствор через полупроницаемую перегородку до тех пор, пока в системе не установится равновесие, которое характеризуется равенством химических потенциалов растворителя в растворе 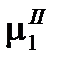 и чистого растворителя
и чистого растворителя 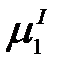 :
:
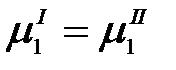
При р, Т = const 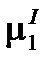 = const, а
= const, а 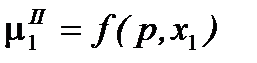 . Продифференцируем
. Продифференцируем 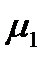 по составу раствора и давлению:
по составу раствора и давлению:
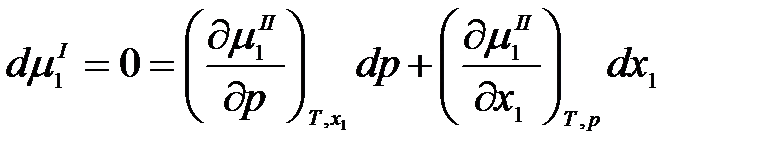 .
.
Для разбавленного раствора мольная доля растворенного вещества х2 → 0, а растворителя х1 → 1, тогда коэффициент активности γ1 → 1, а активность растворителя 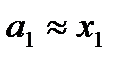 . Химический потенциал растворителя можно выразить:
. Химический потенциал растворителя можно выразить:
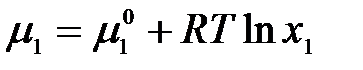 ,
,
тогда
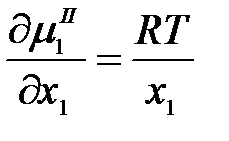 .
.
Так как химический потенциал – это парциальная мольная энергия Гиббса, то
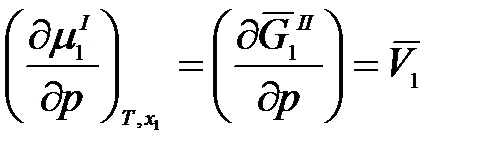 ,
,
где 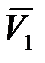 – парциальный мольный объем растворителя.
– парциальный мольный объем растворителя.
Для разбавленного раствора можно принять, что парциальный мольный объем растворителя равен его мольному объему.
Тогда
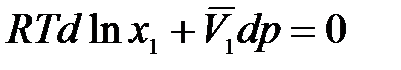 .
.
Можно принять, что
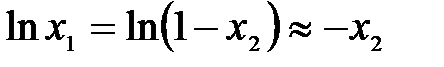 ,
,
тогда
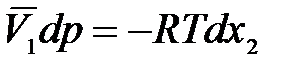 .
.
Проинтегрируем в интервале от внешнего давления 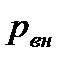 до общего давления
до общего давления 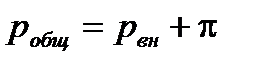 :
:
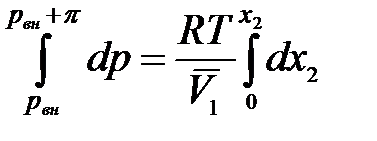 ,
,
где π – избыточное давление, необходимо приложить к раствору с мольной долей х2 для предотвращения осмоса и сохранения равновесия в системе. Поэтому общее давление равно сумме внешнего давления и избыточного (осмотического).
После интегрирования получаем:
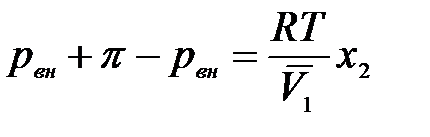 .
.
Для разбавленных растворов
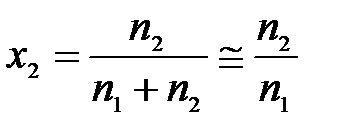 ,
,
тогда
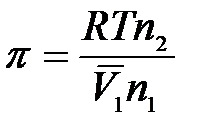 .
.
Произведение
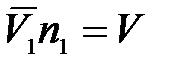 ,
,
где V – объем растворителя.
Тогда
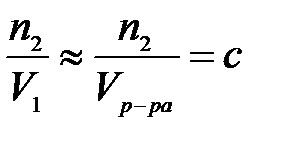 ,
,
где с – число моль растворенного вещества в единице объема раствора (молярная концентрация).
Тогда уравнение для расчета осмотического давления примет вид:
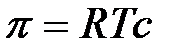 .
.
Полученное уравнение – уравнение Вант-Гоффа – подобно уравнению Менделеева-Клапейрона:
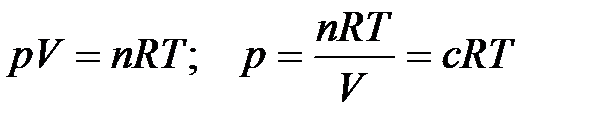 .
.
Оно показывает, что осмотическое давление равно давлению, которое воспроизводило растворенное вещество, если бы оно в виде идеального газа занимало тот же объем, что и в растворе при той же температуре.
Если растворенное вещество диссоциирует, то осмотическое давление рассчитывается по формуле:
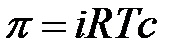 .
.
Явление осмоса лежит в основе различных методов очистки и разделения смесей, которые называются мембранными. Если со стороны раствора приложить внешнее давление, превышающее осмотическое, то равновесие нарушится и химический потенциал растворителя в растворе станет больше, чем чистого растворителя:
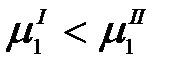
Растворитель будет переходить через полупроницаемую перегородку из раствора в чистый растворитель и будет иметь место концентрирование раствора. Данное явление называется обратным осмосом, а метод разделения жидкой смеси – обратно-осмотическим. Обратный осмос широко применяется для деминерализации воды.
Дата добавления: 2016-06-22; просмотров: 2455;











