Решение типовых задач
Пример 1.В 450 г воды растворили 50 г  . Вычислить процентное содержание кристаллогидрата и безводной соли.
. Вычислить процентное содержание кристаллогидрата и безводной соли.
Решение. Общая масса раствора составляет 500 г. Процентное содержание кристаллогидрата находим из пропорции:
| 500 г раствора | − | 100% |
| 50 » растворенного вещества | − | х » |
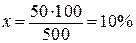
Процентное содержание безводной соли 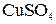 составит
составит
 ,
,
где 31,96 – количество граммов 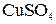 , отвечающее 50 г
, отвечающее 50 г  .
.
Предельную растворимость вещества выражают количеством граммов вещества, которое растворяется в 100 г воды при данной температуре.
Очевидно, если предельная растворимость 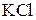 при 0°С составляет 27,6 г, то насыщенный при указанной температуре раствор содержит
при 0°С составляет 27,6 г, то насыщенный при указанной температуре раствор содержит
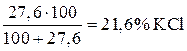 .
.
Если известно, что насыщенный при 40°С раствор 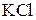 содержит 28,57% растворенной соли, то предельная растворимость вычисляется из пропорции:
содержит 28,57% растворенной соли, то предельная растворимость вычисляется из пропорции:
28,57 г соли растворены в 71,43 г воды
х » » » » 100 » »
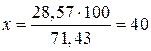 г соли.
г соли.
Пример 2.Сколько граммов соли и воды содержится в 800 г 12%-ного раствора  ?
?
Решение. Масса растворенной соли составляет 12% от массы раствора, т. е.
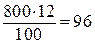 г
г  ,
,
а масса растворителя составляет 88% от массы раствора, т.е.
 г воды.
г воды.
Пример 3.Сколько граммов 3%-ного раствора 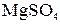 можно приготовить из 100 г
можно приготовить из 100 г 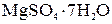 ?
?
Решение. В 100 г 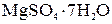 содержится
содержится
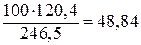 г
г
безводной соли. Согласно условию задачи масса безводной соли составляет 3% массы раствора.
3% массы раствора составляют 48,84 г
100 » » » » х »
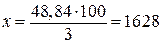 г.
г.
Пример 4.Сколько граммов 5%-ного раствора КОН можно приготовить из едкого кали и 100 г воды?
Решение. Согласно условию задачи 100 г воды составляют 95% массы всего раствора. Отсюда масса раствора равна
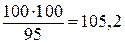 г.
г.
Пример 5.Сколько граммов 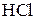 следует растворить в 250 г воды для получения 10%-ного раствора
следует растворить в 250 г воды для получения 10%-ного раствора 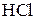 ?
?
Решение. 250 г воды составляют 90 % массы раствора. Масса 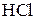 составляет 10% массы раствора или
составляет 10% массы раствора или
 г
г 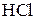 .
.
Пример 6.В каком количестве граммов воды следует растворить 100 г 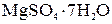 для получения раствора, содержащего 5% безводной соли?
для получения раствора, содержащего 5% безводной соли?
Решение. 100 г 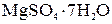 содержит 48,84 г
содержит 48,84 г 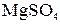 и 51,16 г воды. Согласно условию 48,84 г соли составляют 5% массы раствора. Отсюда масса растворителя равна
и 51,16 г воды. Согласно условию 48,84 г соли составляют 5% массы раствора. Отсюда масса растворителя равна
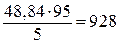 г.
г.
Следовательно, остается добавить 928 – 51,2 = 876,8 г воды.
Можно найти сначала общую массу раствора, которая составит
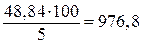 г,
г,
а затем массу растворителя:
976,8 – 100 = 876,8 г воды.
Пример 7.Сколько граммов 10%-ного раствора H2SO4 требуется для обменного взаимодействия с 100 мл 13,7%-ного раствора Na2CO3 (ρ = 1,145).
Решение. Масса 100 мл раствора составляет 114,5 г и содержит
114,5 ∙ 0,137 = 15,68 г Na2CO3.
Из уравнения реакции
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O
Находим необходимое количество серной кислоты:
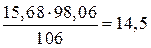 г,
г,
а 10%-ного раствора H2SO4 потребуется
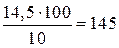 г.
г.
Пример 8.Сколько миллилитров 9,5%-ного раствора Na2CO3 (ρ = 1,10) следует добавить к 100 г воды для получения 3%-ного раствора?
Решение. Обозначим искомый объем раствора через x мл. Масса его в этом случае равна х · 1,10 г, а масса содержащегося в нем Na2CO3 равна х ∙ 1,10 · 0,095 г. Согласно уравнению задачи, масса растворенного вещества составляет 3% от массы полученного раствора (1,10х + 100):
 ,
,
х ≈ 42 мл.
Пример 9.Сколько мл 35%-ного раствора аммиака (ρ = 0,94) требуется для образования 33г (NH4)2SO4?
Решение. Из уравнения реакции
2NH3 + H2SO4 = (NH4)2SO4
находим массу аммиака:
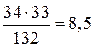 г,
г,
а 35%-ного раствора потребуется
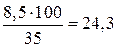 г, или
г, или 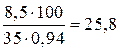 мл.
мл.
Пример 10.Сколько мл 32,5%-ного раствора NH3 (ρ = 0,888) требуется для образования сульфата аммония (NH4)2SO4 с 250 мл 27,3%-ного раствора H2SO4 (ρ = 1,2)?
Решение. Масса раствора кислоты составляет 250 ∙ 1,2 = 300 г. Раствор содержит 300 · 0,273 = 81,9 г H2SO4 . Согласно уравнению
2NH3 + H2SO4 = (NH4)2SO4
вычисляем массу аммиака, вошедшего в реакцию; она составляет
 г NH3.
г NH3.
Этому количеству граммов NH3 соответствует
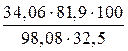 г
г
или
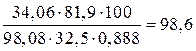 мл
мл
его 32,5%-ного раствора.
Пример 11. Вычислить молярную концентрацию, молярную концентрацию эквивалента, титр и моляльность 10% - го раствора Al2(SO4)3 (ρ = 1,105 г/см3).
Решение. 1. Масса 1 л раствора тр-ра = ρVр-ра = 1,105 ∙1000 =115 г. По определению массовой доли, в 100 г раствора содержится 10 г Al2(SO4)3, следовательно, в 1105 г (т. е. в 1 л) соответственно (1105 ·10)/100 = 110,5 г. Молярная масса Al2(SO4)3 М(Al2(SO4)3) = 342 г/моль. Таким образом, в 1 л раствора содержится 110,5/342 = 0,32 моль Al2(SO4)3 и молярная концентрация раствора см равна 0,32 моль/л.
2. Эквивалент молекулы Al2(SO4)3 равен 1/6 молекулы: Э(Al2(SO4)3) = 1/6 (М(Al2(SO4)3)). Следовательно, в одном моле Al2(SO4)3 содержится шесть моль-эквивалентов, а в 1 л данного раствора 0,32 · 6 = 1,92 моль-экв Al2(SO4)3. Молярная концентрация эквивалента (или нормальная концентрация) сн равна 1,92 моль/л или 1,92 н.
3. Поскольку выше было найдено, что в 1000 мл раствора содержится 110,5 г растворенного вещества, то в 1 мл находится 110,5/1000 = 0,1105 г Al2(SO4)3 и титр раствора Т = 0,1105 г/мл.
4. По условию в 100 г раствора содержится 10 г Al2(SO4)3 и 90 г Н2О. Тогда на 1000 г воды приходится (1000 · 10)/90 = 111,11 г Al2(SO4)3. Это составляет 111,11/342 = 0,325 моль. Следовательно, в 1000 г растворителя содержится 0,325 моль растворенного вещества Al2(SO4)3 и моляльность раствора ст,по определению, равна 0,325 моль/1000 г Н2О.
Пример 12.Константа диссоциации муравьиной кислоты НСООН, диссоциирующей по уравнению
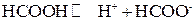
составляет 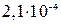 . Вычислить a и
. Вычислить a и  для 0,3 М раствора этой кислоты.
для 0,3 М раствора этой кислоты.
Решение.

что соответствует 2,64 %
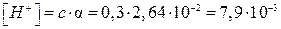 моль/л;
моль/л;
Вариант решения. Напишем выражение для константы диссоциации в общем виде:
 .
.
Числитель представляет собой произведение концентраций ионов; эти концентрации равны друг другу, поэтому числитель можно заменить выражением 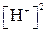 . Знаменатель представляет собой концентрацию недиссоциированной части кислоты, которую, если пренебречь диссоциированной частью, примем равной общей концентрации электролита (то же допущение делается и при выводе формулы
. Знаменатель представляет собой концентрацию недиссоциированной части кислоты, которую, если пренебречь диссоциированной частью, примем равной общей концентрации электролита (то же допущение делается и при выводе формулы 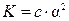 , когда величина 1 - a принимается равной 1). В этом случае
, когда величина 1 - a принимается равной 1). В этом случае

Находим  :
:
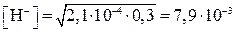 моль/л;
моль/л;

Пример 13. Концентрация гидроксильных ионов 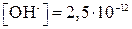 моль/л. Вычислить рН.
моль/л. Вычислить рН.
Решение.
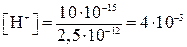 моль/л,
моль/л,
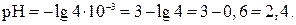
Или, если 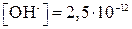 моль/л, то
моль/л, то 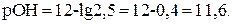 Учитывая, что рН + рОН = 14, находим рН = 14 – 11,6 = 2,4.
Учитывая, что рН + рОН = 14, находим рН = 14 – 11,6 = 2,4.
Пример 14. рН раствора составляет 4,3. Вычислить  и
и 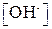 .
.
Решение.
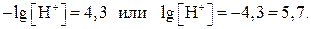
0,7 – это логарифм коэффициента, стоящего при 10-5. Этому логарифму соответствует число 5, следовательно,
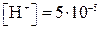 моль/л, а
моль/л, а 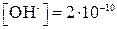 моль/л.
моль/л.
Соотношение между  рН и рОН
рН и рОН
Усиление кислотного характера среды
| Нейтральная среда | |||||||
| рН | ||||||||

| 10-1 | 10-2 | 10-3 | 10-4 | 10-5 | 10-6 | 10-7 | |
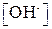
| 10-14 | 10-13 | 10-12 | 10-11 | 10-10 | 10-9 | 10-8 | 10-7 |
| рОН | ||||||||
| Нейтральная среда | Усиление щелочного характера среды
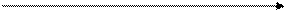
| |||||||
| рН | ||||||||

| 10-7 | 10-8 | 10-9 | 10-10 | 10-11 | 10-12 | 10-13 | 10-14 |
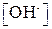
| 10-7 | 10-6 | 10-5 | 10-4 | 10-3 | 10-2 | 10-1 | |
| рОН |
Для вычисления рН растворов кислот и оснований следует предварительно вычислить 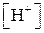 или
или 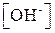 .
.
Пример 15.Вычислить рН 1/400 М раствора КОН.
Решение. Принимая, что активность иона ОН- практически равна его концентрации, находим
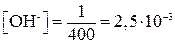 моль/л;
моль/л;
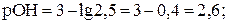
рН = 14 – 2,6 = 11,4.
Пример 16.Вычислить рН 1%-ного раствора муравьиной кислоты, считая, что плотность раствора равна 1; 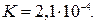
Решение. 1 л раствора содержит 10 г НСООН, что составляет 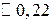 моль/л.
моль/л.


Пример 17. Определите температуру кипения раствора, содержащего 1,84г нитробензола C6N5NO2 в 10 г бензола. Эбуллиоскопическая постоянная бензола 2,53. Температура кипения чистого бензола 80,20С.
Решение.
По закону Рауля
 , (17)
, (17)
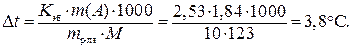
Температура кипения раствора: 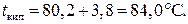
Пример 18. Раствор, содержащий 1,22 г бензойной кислоты C6H5COOH в 100 г сероуглерода, кипит при 46,529 0С, температура кипения сероуглерода 46,3 0С. Вычислите эбуллиоскопическую константу сероуглерода.
Решение.
Повышение температуры кипения ∆t = 46,529 – 46,3 = 0,2290. Молярная масса бензойной кислоты 122 г/моль. Из формулы (1) находим эбуллиоскопическую константу:
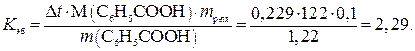
Пример 19. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при –0,2790C. Вычислить молярную массу глицерина.
Решение.
Температура кристаллизации чистой воды 00С, следовательно, понижение температуры кристаллизации ∆t = 0 – (– 0,279) = 0,2790. Подставляя в уравнение (1) данные вычисляем молярную массу глицерина:

Дата добавления: 2020-03-21; просмотров: 561;











