Зависимость скорости реакции от температуры
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа, согласно которому при повышении температуры на 10°Сскорость реакции возрастает примерно в 2-4 раза.
Число, показывающее во сколько раз увеличивается скорость химической реакции, а следовательно и константа скорости её при повышении температуры на 10°С, называется температурным коэффициентом скорости реакции 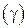 .
.
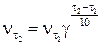 ,
,
где 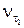 – скорость реакции при температуре
– скорость реакции при температуре 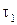
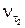 – скорость реакции при температуре
– скорость реакции при температуре 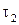
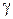 – температура коэффициент скорости равный
– температура коэффициент скорости равный 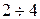
Пример. Срок хранения автомобильных покрышек при температуре 20˚С – 5 лет, а при температуре 10˚С – 13 лет. Сколько лет можно хранить покрышки при 5˚С?
Решение. Средняя скорость старения резины обратно пропорциональна сроку хранения. Следовательно, при охлаждении с 20˚С до 10˚С скорость старения уменьшится в 13/5 = 2,6 раза. Это означает, что температурный коэффициент γ = 2,6. При охлаждении еще на 5˚С скорость реакции уменьшится в γ1/2 = 1,6 раза:
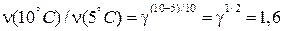
В такое же число раз возрастет срок хранения покрышек, который в этом случае составит уже 13 ∙ 1,6 = 21 год.
Увеличение скорости реакции с повышением температуры объясняется тем, что для химической реакции необходимо соударение активных молекул. При повышении температуры число активных молекул возрастает, поэтому скорость химическойреакции резко возрастает.
Избыточная энергия, которой должны обладать молекулы для того, что бы их столкновение могло привести к образованию нового вещества, называется энергией активации (в кДж/моль).
Молекулы, обладающие такой энергией, называются активными молекулами.
Если энергия активации мала (< 40 кДж/моль), то скорость химической реакции велика, если энергия активации велика ( >120 кДж/моль) то скорость реакции очень мала.
В 1889 году шведский ученый Аррениус вывел уравнение, которое носит его имя: 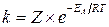 – уравнение Аррениуса, где k – константа скорости реакции, ЕА– энергия активации, R – газовая постоянная, T – абсолютная температура, Z – число столкновений.
– уравнение Аррениуса, где k – константа скорости реакции, ЕА– энергия активации, R – газовая постоянная, T – абсолютная температура, Z – число столкновений.
Множитель 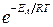 характеризует долю активных столкновений от их общего числа. Мы видим, что константа скорости тем больше, чем меньше энергия активации и чем выше температура.
характеризует долю активных столкновений от их общего числа. Мы видим, что константа скорости тем больше, чем меньше энергия активации и чем выше температура.
Реакции, требующие для своего протекания заметной энергии активации, начинаются с ослабления связи между атомами в молекулах исходных веществ.
При этом вещества переходят в неустойчивое промежуточное состояние с большим запасом энергии, это состояние называется активированным комплексом. Для его образования и необходима энергия активации (рис. 4.1.).
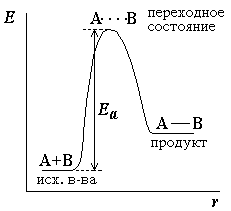 Рис. 4.1. Энергетическая диаграмма для реакции образования продукта АВ из исходных веществ А и В.
Рис. 4.1. Энергетическая диаграмма для реакции образования продукта АВ из исходных веществ А и В.
| В активированном комплексе старые связи еще не разорваны, но уже ослаблены, новые связи наметились, но еще не образовались. Для образования переходного комплекса и необходима энергия активации. Если энергия столкновения молекул А и В больше или равна энергии активации Еа, то энергетический барьер преодолевается, и происходит перемещение вдоль координаты реакции r от исходных веществ к продукту. Вершина энергетического барьера соответствует переходному состоянию (активированному комплексу), в котором связь А–В образовалась частично. |
Катализ
Наиболее мощным средством интенсификации химических реакций является применение катализаторов, т.е. веществ, которые ускоряют химические реакции, но в результате не испытывают химические превращения. Явление изменения скорости под воздействием катализаторов называется катализом.
Кроме способности ускорять реакции, многие катализаторы обладают селективностью (избирательностью). Под влиянием катализаторов реакции могут протекать избирательно, т.е. с увеличением выхода определенных продуктов. Например, этанол в присутствии оксидов алюминия и тория разлагается на этилен и воду:
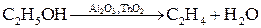
а в присутствии никеля, железа, серебра или меди – на ацетальдегид и водород:
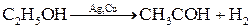
Каталитическая активность, т.е. способность ускорения реакции, многих катализаторов возрастает при добавлении небольших количеств некоторых веществ, называемых промоторами, которые без катализатора могут быть каталитически неактивными. Например, скорость окисления 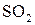 на катализаторе оксиде ванадия
на катализаторе оксиде ванадия 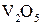 возрастает в сотни раз при добавлении в систему сульфатов щелочных металлов.
возрастает в сотни раз при добавлении в систему сульфатов щелочных металлов.
В то же время имеются вещества, которые ухудшают каталитическую активность. Их называют каталитическими ядами. Например, каталитическими ядами платиновых катализаторов являются соединения серы, мышьяка, ртуть.
Особенности катализаторов:
1) Катализатор не меняет стехиометрическое уравнение реакции.
2) Катализатор в равной степени изменяет скорости прямой и обратной реакций, следовательно, с помощью катализатора невозможно сместить химическое равновесие.
3) Катализатор не изменяет энтальпию и энергию Гиббса. Если энергия Гиббса реакции положительна, то в присутствии катализаторов она не станет самопроизвольной.
4) Катализаторы уменьшают полную энергию активации процесса, так как каталитический процесс идет по другому пути, через другое переходное состояние, с образованием других промежуточных частиц. Активированный комплекс с участием катализаторов, имеет меньшую энергию, чем комплекс без катализаторов, поэтому энергия активации каталитической реакции ниже, чем энергия некаталитической реакции, т.е. Еа>Еа,к (рис. 4.2.).
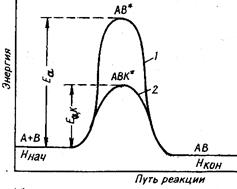 Рис. 4.2. Энергетическая диаграмма некаталитической (1) и каталитической (2) реакции
А + В = АВ
Рис. 4.2. Энергетическая диаграмма некаталитической (1) и каталитической (2) реакции
А + В = АВ
| В некоторых случаях каталитические реакции протекают с образованием не одного, а двух и более активированных комплексов. Однако суммарная энергия активации каталитического процесса все равно ниже, чем процесса без катализаторов Еа,к1 + Еа,к2 < Еа. Механизм катализатора зависит от типа реакции. Различают гомогенный и гетерогенный катализ. |
Гомогенный катализ. При гомогенном катализе реагирующие вещества и катализатор находятся в одной фазе. Механизм гомогенного катализа можно объяснить на основе теории промежуточных соединений. Согласно этой теории, катализатор образует с реагентами промежуточные соединения, причем разложение последнего является лимитирующей стадией. Это приводит к уменьшению энергии активации реакции. Например, реакция:
АВ + D → A. . .B. . .D → A + BD
в присутствии катализатора К может проходить по схеме:
D + K ↔ D. . .K ↔ DK
DK + AB ↔ A. . .B. . .D. . .K ↔ A + BD + K
Как видим, в суммарное уравнение реакции катализатор К не входит, т.е. в результате реакции он не изменяется. Примером газофазной каталитической гомогенной реакции является реакция окисления оксида углерода в присутствии паров воды:
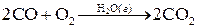
Более распространены гомогенные каталитические реакции в жидкой фазе. Например, реакция разложения пероксида водорода:
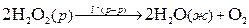
ускоряется иодид-ионами. Эту реакцию можно записать в виде схемы:
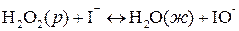
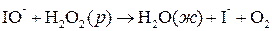
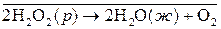
Гетерогенный катализ. Если катализаторы и реагенты находятся в разных фазах и имеют границу раздела, то катализ называется гетерогенным. Гетерогенными обычно являются твердые катализаторы, на поверхности которых реагируют газообразные или жидкие вещества.
Суммарная скорость химического превращения на гетерогенном катализаторе зависит от площади его поверхности, поэтому обычно применяют катализаторы с развитой поверхностью.
Механизм каталитических гетерогенных реакций очень сложен и зависит от природы реакции. Все каталитические гетерогенные реакции включают в себя стадии адсорбции и десорбции. За счет энергии адсорбционного взаимодействия с поверхностными атомами катализатора химические связи реагирующих веществ ослабляются, а иногда и разрываются. Например, реакция гидрогенизации этилена на катализаторе протекает через стадии:
адсорбции
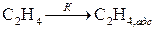
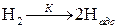
и десорбции
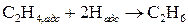
Дата добавления: 2020-03-21; просмотров: 2105;











