Решение типовых задач
Пример 1. Вычислить равновесные концентрации водорода и йода, если известно, что их начальные концентрации составляли по 0,02 моль/л, а равновесная концентрация НI – 0,03 моль/л. Вычислить константу равновесия.
Решение. Из уравнения реакции
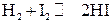
видно, что на образование 0,03 моля НI расходуется 0,015 моля водорода и столько же йода, следовательно, их равновесные концентрации равны и составляют 0,02 - 0,015 = 0,005 моль/л, а константа равновесия
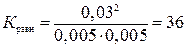 .
.
Пример 2.В системе 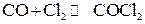 равновесные концентрации веществ
равновесные концентрации веществ 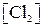 =0,3 моль/л,
=0,3 моль/л, 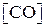 =0,2 моль/л и
=0,2 моль/л и 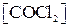 =1,2 моль/л. Вычислить константу равновесия системы и начальные концентрации хлора и окиси углерода.
=1,2 моль/л. Вычислить константу равновесия системы и начальные концентрации хлора и окиси углерода.
Решение. Из уравнения реакции видно, что для образования 1,2 моля  расходуется по 1,2 моля
расходуется по 1,2 моля  и
и 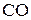 . Следовательно, исходная концентрация хлора 0,3 + 1,2 = 1,5 моль/л, окиси углерода 0,2 + 1,2 = 1,4 моль/л. Константа равновесия
. Следовательно, исходная концентрация хлора 0,3 + 1,2 = 1,5 моль/л, окиси углерода 0,2 + 1,2 = 1,4 моль/л. Константа равновесия
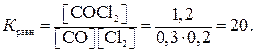
Пример 3.Во сколько раз возрастет скорость реакции взаимодействия оксида углерода (II) с кислородом, если концентрации исходных веществ увеличить в три раза?
Решение. 1) Записываем уравнение реакции:
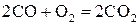
Согласно закону действующих масс
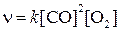
2) Обозначим 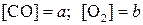 , тогда:
, тогда: 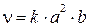
3) При повышении концентрации исходных веществ в 3 раза получим:
 , а
, а 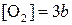
4) Рассчитываем скорость реакции  :
:
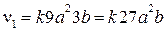 , а
, а
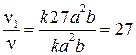 , т.е. скорость реакции возрастет в 27 раз.
, т.е. скорость реакции возрастет в 27 раз.
Пример 4. Во сколько раз возрастет скорость химической реакции при повышении температуры на 40˚С, если температурный коэффициент скорости реакции равен 3?
Решение. Согласно правилу Вант – Гоффа:
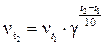
 , т.е. скорость реакции возрастет в 81 раз.
, т.е. скорость реакции возрастет в 81 раз.
Пример 5. Реакция при температуре 30˚С протекает за 2 минуты. За сколько времени закончится эта реакция при температуре 60˚С, если температурный коэффициент скорости равен 2?
Решение. 1) В соответствии с правилом Вант – Гоффа:
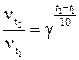
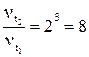
2) Скорость реакции обратно пропорциональна времени реакции, следовательно:
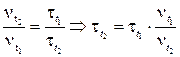
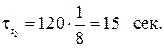
Пример 6. Реакция образования оксида азота (IV) выражается уравнением
 .
.
Как изменится скорость прямой и обратной реакций, если увеличить давление в 3 раза, а температуру оставить постоянной? Вызовет ли это изменение скорости смещение равновесия?
Решение. Пусть до увеличения давления равновесные концентрации оксида азота (II), кислорода и оксида азота (IV) были: [NO] = a, [O2] = b,
[NO2] = c, тогда скорость прямой реакции
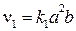 ,
,
скорость обратной реакции
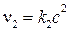 .
.
При увеличении давления в 3 раза во столько же раз увеличатся концентрации всех реагентов: [NO] = 3a, [O2] = 3b, [NO2] = 3c.
Скорость прямой реакции станет:
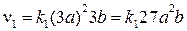
Скорость обратной реакции станет:
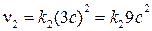 .
.
Скорость прямой реакции возросла в 27 раз, а обратной – в 9 раз. Равновесие сместится в сторону прямой реакции, что согласуется с принципом Ле Шателье.
Пример 7. Как влияют на равновесие в системе
 , (ΔН<0)
, (ΔН<0)
а) понижение давления;
б) повышение температуры;
в) увеличение концентрации исходных веществ?
Решение. Согласно принципу Ле Шателье понижение давления приведет к смещению равновесия в сторону реакции, приводящей к увеличению ее объема, т.е. в сторону обратной реакции. Повышение температуры приведет к смещению равновесия в сторону эндотермической реакции, т.е. в сторону обратной реакции. И, наконец, увеличение концентрации исходных веществ приведет к смещению равновесия в сторону образования продуктов реакции, т.е. в сторону прямой реакции.
Пример 8. Рассмотрим химическое равновесие

Определим равновесные концентрации NH3 для двух равновесных смесей:
1. [N2] = 0,1 M и [H2] = 0,1 M.
2. [N2] =1,0 M и [H2] = 0,1 M.
Константа равновесия К = 6,0 ∙ 10-2 при 525 ˚С
Решение. Составим выражение для константы химического равновесия, подставим в него известные величины и произведем вычисления.
Первый вариант химического равновесия:
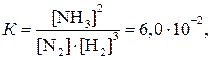
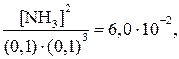 откуда
откуда 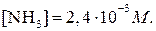
Второй вариант химического равновесия
 откуда
откуда 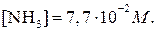
Вывод. При увеличении в равновесной смеси концентрации N2 (реагента) повышается концентрация NH3 (продукта реакции).
Дата добавления: 2020-03-21; просмотров: 524;











